Основы химии
![]() Vt2= Vt1* γ(t2–t1/10) уравнение Вант–Гоффа
Vt2= Vt1* γ(t2–t1/10) уравнение Вант–Гоффа
где Vt2 и Vt1 –скорости реакции соответственно при температурах t2 и t1 (t2>t1); γ – температурный коэффициент.
γ=К(t+10)/Kt=V(t+10)/Vt=2–4
Kt1/Kt2= γt2–t1/10
Для реакции окисления водорода повышение температуры от 273 до 3730 при γ=2 скорость увеличивается в 1024 раза.
V373/V273= γ 373–273/10=2100/10=210=1024
Уравнение Вант–Гоффа является упрощенным выражением зависимости скорости реакции от температуры. С его помощью можно лишь примерно оценить влияние температуры на скорость реакции. Более точная зависимость скорости от температуры представлена соотношением шведского ученого Сванте Аррениуса (1889г)
![]() Аррениус показал, что константа скорости реакции К имеет следующую зависимость от температуры
Аррениус показал, что константа скорости реакции К имеет следующую зависимость от температуры
lnK= -(E/RT+C)
отсюда К=А*е-(E/RT). В этом выражении А – постоянный множитель, не зависящий от температуры и концентраци; е – основание натурального логарифма (равное 2,713); Т – абсолютная температура в Кельвинах (К); Е – энергия активации (кДж/моль), т.е. та энергия, которую нужно сообщить молекулам (частицам), находящимся в исходном состоянии, чтобы они могли вступить в реакцию; R – универсальная газовая постоянная (8,314 Дж/моль*К).
По теории Аррениуса химическая реакция может происходить только при столкновении активных частиц. Активными считаются частицы, имеющие такое количество энергии, которое необходимо для осуществления реакции, т.е. для преодоления сил отталкивания, возникающих между электронными оболочками частиц, и их взаимодействия. Активные частицы, прежде чем превратиться в конечный продукт, при столкновении друг с другом образуют промежуточную группировку, называемую активированным комплексом. Активированный комплекс является очень неустойчивым переходным состоянием системы, в котором происходит перераспределение химических связей. В дальнейшем исходные химические связи окончательно разрушаются и образуются конечные связи, образуются продукты реакции.
Для реакции
А2+В2=2АВ
процесс взаимодействия графически можно изобразить так:
![]()
![]() А В А … А А А
А В А … А А А
![]()
![]() | + | | + |
| + | | + |
А В В … В В В
начальное состоя- переходное состоя- конечное состояние
ние системы ние системы (акти- системы (продукты
(реагенты) вированный комплекс) реакции)
Для того, чтобы исходные вещесива (реагенты) достигли переходного состояния (превратились в активированный комплекс) система должна получить определенное количество энергии, называемое энергией активизации.
Энергия активизации, входящая в уравнение Аррениуса, представляет собой разность между средней энергией реагирующих частиц и энергией активированного комплекса.
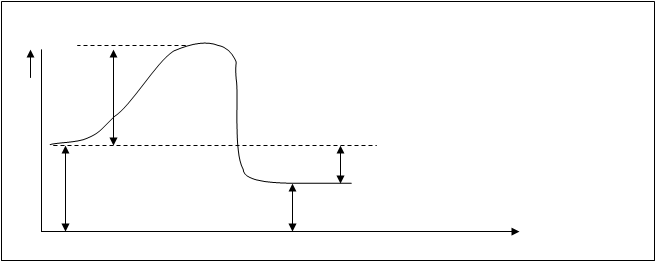 Энергия активизации – своя величина для каждого процесса, это значит, что она является характеристической величиной конкретной реакции можно сказать, что она определяет влияние на скорость химической реакции природы реагирующих веществ. Если сравнивать энергию активизации и энергию диссоциации веществ, то энергия активизации по величине меньше, чем энергия диссоциации наименее прочной связи в молекулах реагирующих веществ. На следующей энергетической схеме для экзотермической реакции А+В=АВ (рис.10.4.) дано соотношение между величиной различных энергий.
Энергия активизации – своя величина для каждого процесса, это значит, что она является характеристической величиной конкретной реакции можно сказать, что она определяет влияние на скорость химической реакции природы реагирующих веществ. Если сравнивать энергию активизации и энергию диссоциации веществ, то энергия активизации по величине меньше, чем энергия диссоциации наименее прочной связи в молекулах реагирующих веществ. На следующей энергетической схеме для экзотермической реакции А+В=АВ (рис.10.4.) дано соотношение между величиной различных энергий.
Активированый
комплекс
Н А…В
Е
А+В
ΔН реакции
Σ Н реагентов
Σ Н продукты реакции
путь реакции
Рис.10.4. Энергетическая схема хода реакции А+В=Д
Активация молекул может быть осуществлена при нагревании или растворении вещества, при выделении энергии в ходе самой реакции, при поглощении ими квантов светового, радиоактивного, рентгеновского или другого излучения, под действием ультрозвука, электрического разряда и даже при ударе о стенку сосуда.
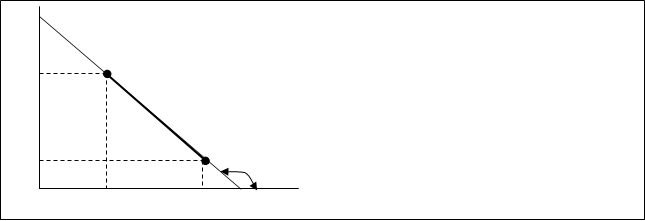 По теории Аррениуса зависимость ln”K” от 1/Т имеет линейный характер (рис.10.5.)
По теории Аррениуса зависимость ln”K” от 1/Т имеет линейный характер (рис.10.5.)
lnK
lnK2
Рис.10.5. Зависимость lnK от 1/Т
lnK1 α
0
1/T1 1/T2 1/T
![]() Исходя из графической зависимости lnK от 1/Т можно расчитать энергию активации.
Исходя из графической зависимости lnK от 1/Т можно расчитать энергию активации.
Е=Rtgα
Это значит, что энергию активации можно определять из анализа экспериментальных данных по зависимости скорости реакции от температуры.
По закону действующих масс скорость реакции А+В=АВ выражается следующим кинетическим уравнением:
V=K[A][B]
Выражение К определяем из соотношения Аррениуса:
К=А*е–Е/RT
и подставляем в кинетическое уравнение реакции:
V= А*е–Е/RT[а][в]
Произведем замену величины А[а][в] на Z и получаем значение:
V=Z*е–Е/RT
Прологарифмировав это выражение, будем иметь уравнение:
lgV=lgZ – (E/RT)lge=lgZ – (0,434E/R)*1/T
lgV= -(0,434E/R)*1/T
которое является уравнением прямой в координатах lgV и 1/T, как это представлено на рис.10.5.
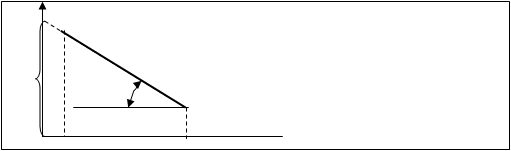 lgV
lgV
lgZ Рис.10.5.
β
1/T
Из графика (рис.10.5.) определяют тангенс угла β:
tgβ=lgV/(1/T) = ((-0,434E/R)*(1/T))/1/T = -0,434E/R
Последнее выражение позволяет определить энергию активации Е
Е= -tgβR/0,434
10.2.4. Влияние давления.
В случае взаимодействия газообразных реагентов, на скорость реакции влияет также давление . Повышение давления равноценно увеличению концентрации газов. Сжатие системы в два раза соответственно приводит к увеличению концентрации каждого из газов тоже в два раза. Мы уже знаем, что зависимость скоростьи простых реакций от концентраций определяется законом действующих масс. Следовательно, по этому закону можно в принципе оценивать, во сколько раз изменится скорость реакции при изменении величины давления в данной системе.
В рамках теории химической кинетики зависимость константы скорости от давления выражается следующим уравнением:
(σlnK/Pσ)T= -ΔV/RT
в котором ΔV – разность между суммой мольных объемов исходных веществ и мольным объемом активированного комплекса, т.е. изменение объема при переходе реагентов в активированное состояние.
10.3. Катализаторы. Гомогенный катализ.
Скорость реакции часто зависит от присутствия в системе “постороннего” вещества с которым реагенты способны образовывать промежуточные соединения (активированный комплекс) и этим ускорять реакцию. Такие “посторонние” вещества называют катализаторами.
Катализатором называют такое вещество, которое своим присутствием и участием в реакции изменяет скорость, но в конечном итоге выделяется в первоначальном (качественном и количественом) виде. Увеличение скорости реакции при помощи катализатора называют катализом. Если катализатор находится в таком же агрегатном состоянии что и реагенты и между взаимодействующими веществами и катализатором нет поверхности раздела, то такой катализ называют гомогенным.
