Основы химии
АО АО МО АО
С исходн. С*гибрид. СО2 2О
sхраз
py,zраз
2Pyz
2P 2Px,y,z
p*y,z
2S 2SPx
sхсв
pyсо,z 2S
ss*
Рис.4.30. Схема расположения МО в молекуле СО2.
Несвязующими становятся еще четыре орбитали. Они переходят в молекулу СО2 от двух атомов кислорода (две от 2s-атомных орбиталей и две от 2p-АО). Электронная структура молекулы может быть представлена следующей электронной формулой:
C+2O=СО2 [(ppy,zсв)4(ss,xсв) 4(p*py,z)4]. K.C.c-o=(8-0/2):2=2
 Ион СО22-. Схема молекулярных орбиталей в карбонат-ионе СО22-показана на рис.4.31.
Ион СО22-. Схема молекулярных орбиталей в карбонат-ионе СО22-показана на рис.4.31.
Е АО АО МО АО
С исход. С*гибрид. СО22- sхраз 3О
pzраз
2Px,y,z 2Pz
py*
2S 2Px,y,z
sхсв
pzсв
ss* 2S
Рис.4.31. Схема расположения МО в карбонат-ионе СО22-.
В карбонат-ионе несвязующими МО являются орбитали полученные от 2S-АО трех атомов кислорода (их три: ss*), а также три орбитали ppy*, полученные в результате превращения трех 2Р-атомных орбиталей кислорода. На МО карбонат-иона находятся два неспаренных электрона, расположенных на pz-разрыхляющих орбиталях. Электронная формула карбонат-иона следующая:
C+3O+2e=СО22- [(pzсв)2(pzсв)2(sхсв)2(sхсв)2(sхсв)2(pzx)6(pz,zраз)2].
Кратность связи составляет (10-2/2):3=1,33.
Подобную структуру имеет нитрат-ион NО3-. Он является изоэлектроном иону СО22-.
Из рассмотренного можно сделать следующий вывод относительно основных характеристик ковалентной связи.
Ковалентная связь.
1). Обладает полярностью.
2). Имеет направленность.
3). Стремится к насыщаемости.
4). Является очень прочной.
Молекулы химических соединений, образованные ковалентной связью, имеют определенный количественный и качественный состав (например, молекула воды состоит из одного атома кислорода и двух атомов водорода. 88,9% от массы молекулы воды приходится на кислород и 11,1% - на водород). Ковалентные молекулы характеризуются конкретной геометрической конфигурацией (молекулаСН4-тетраэдр, молекула BeCl4-линейная). Ковалентные молекулы могут проявлять либо парамагнитные, либо диамагнитные свойства. Химические соединения с ковалентной связью могут иметь разные агрегатные состояния: твердое, жидкое и газообразное (CuO-твердый, TiCl4-жидкость, SO2-газ).
4.4 Ионная связь.
Само название связи – ионная – указывает на то, что связь возникает в результате взаимодействия ионов.
Ионной называют такую связь, которая образуется между катионом и анионом в результате их электростатического взаимодействия.
Правомерно встает вопрос, когда химические элементы могут превращаться в положительно и отрицательно заряженные ионы (катионы и анионы).
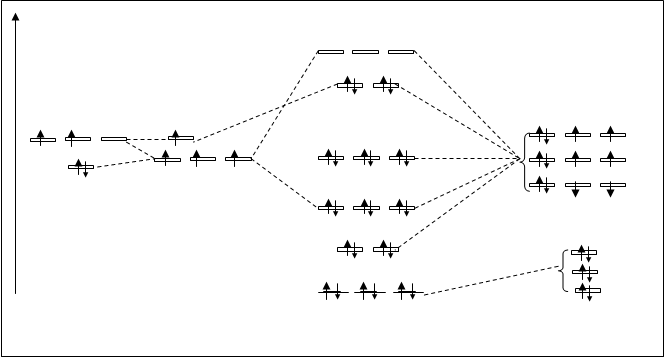
Рассматривая полярную ковалентную связь выяснили, что область перекрывания орбиталей взаимодействующих атомов (т.к. область перекрывания орбиталей дает увеличение электронной плотности создаваемой парой электронов, для простоты будем использовать понятие “электронная пара”), общая электронная пара смещается в сторону более электроотрицательного элемента. Величина полярности молекулы оценивается дипольным моментом m. Из расчета дипольного момента полярных молекул выяснили, что при m >4,8Д полярная ковалентная связь превращается в ионную. В этом случае электрон внешней оболочки одного атома переходит на оболочку более электроотрицательного атома. Такой переход возможен при взаимодействии атома лития с атомом фтора. Это показано на рис.4.32.
Под действием поля атома фтора один электрон из внешней оболочки лития переходит на оболочку фтора. Оба атома приобретают устойчивые оболочки (литий – двухэлектронную оболочку, фтор - восьмиэлектронную оболочку), но при этом оба атома становятся ионами: литий – положительно заряженным – катионом, а фтор - отрицательно заряженным – анионом. Относительная электроотрицательность лития равна 1 (ЕLi=1), а фтора – 4 (ЕF=4). Разность в электроотрицательностях составляет три единицы(DЕ=3). Считается, что полярная ковалентная связь превращается в ионную при разности в электроотрицательностях взаимодействующих атомов более 1,9 единицы.
 |
+3 + +9 +3 + +9
Li F Li+ F—
+ + — + —
Li+ F— LiF
Рис.4.32. Образование ионной молекулы LiF.
![]() Следовательно, эта величина как бы является критерием образования ионной связи. DЕ>1,9.
Следовательно, эта величина как бы является критерием образования ионной связи. DЕ>1,9.
Более точной оценкой степени ионности полярной связи может быть расчет отношения заряда диполя q к заряду электрона е: q/e. Cделаем оценку степени ионности связи в молекуле HCl. При длинные связи l=1,27 А0 и величине заряда диполя q=e=4,8*1010 эл.ст.ед. Расчетное значение дипольного момента будет: mтеор.=l*q= =1,27*10-8 * 4,8*10-10 =6,11Д. Экспериментально определенное значение mэкс.=1,039 Д.
значение mэкс.=1,039 Д. Тогда отношение q к е составит: q/e= mэкс./ mтеор.*100=17%
Степень ионности связи в молекуле НCl всего 17%. Остальные 83% составляет ковалентный характер связи. Обычно считают, что связь является приемущественно ионной, когда степень ионности q/е>50%. При критерии DЕ >1,9 молекула приобретает степень ионности более 50%.
100%-ной ионной связи практически не бывает. Для 100%-ной ионной связи необходимо, чтобы разность в электроотрицательностях элементов DЕ достигла величины 3,5. На самом деле, наиболее крайние по электроотрицательности элементы франция (Fr) и фтора (F) имеют всего DЕ =3,3.
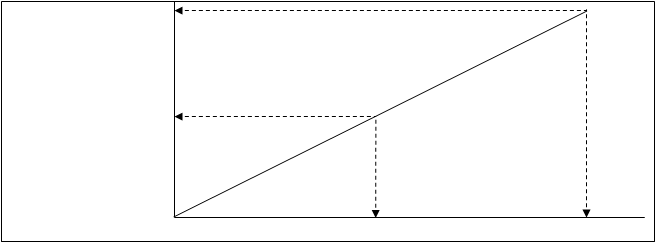 На рис.4.33. дана зависимость степени ионности связи (q/e) от разности в электроотрицательностях атомов DЕ.
На рис.4.33. дана зависимость степени ионности связи (q/e) от разности в электроотрицательностях атомов DЕ.
q/e*100% 100
Рис.4.33. зависи- 90 ионные связи
мость степени 80
ионности связи 70
от разности 60
электроотрица- 50
тельности атомов. 40 ковалентные
30 связи
20
10
0,4 0,8 1,2 1,6 2,0 2,4 2,8 3,2 3,6 DЕ
Рассмотрим свойства ионной связи на примере хлорида натрия. В следствии противоположности зарядов оба иона Na+и Сl- притягиваются друг к другу. Однако, сблизившись до определенного предела, они останавливаются на оптимальном расстоянии (r0), при котором притяжение уравновешивается взаимным отталкиванием их электронных оболочек.
Положительно и отрицательно заряженные ионы, образующие ионное соединение, представим в виде заряженных шариков, силовые поля которых равномерно распределяются в пространстве во всех направлениях (рис.4.34.)
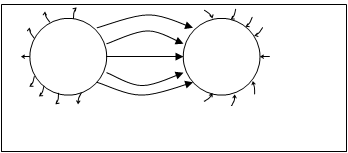 Рисунок 4.34. наглядно показы-
Рисунок 4.34. наглядно показы-
вает, что ионы держатся друг возле
+ — друга за счет силового электростати-
ческого поля. Насыщаемость силовых
линий происходит только в области
Рис.4.34. Распределение электрических между ионами, а по бокам каждого ио- силовых полей двух разноименных ионов. на силовые линии не компенсируются.
