Рефрактометрический метод анализа в химии
Кривые зависимостей показателя преломления от состава бинарных растворов существенно изменяются с изменением природы раствора. Эти кривые подразделяют на три типа:
I тип – изотермы, имеющие незначительную положительную или отрицательную кривизну, когда изменение n от состава отличается от линейного хода по величине не более, чем на 0,0075-0,008 (рис. 4а);
II тип – изотермы, имеющие заметную кривизну, когда Δn > 0,008 (рис. 4б);
III тип – изотермы с сингулярной точкой (рис. 4в).
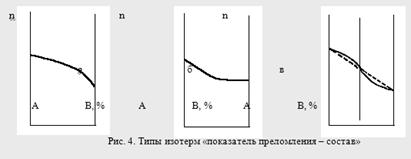
Большинству бинарных растворов соответствуют кривые I-го типа. Сюда относятся нормальные растворы и растворы с ассоциированными компонентами, а также растворы с химическим взаимодействием компонентов и растворы, в которых по каким-либо причинам такое взаимодействие не проявляется отчётливо на изотерме "показатель преломления – состав".
К растворам типа II и III относятся растворы с сильно выраженным химическим взаимодействием компонентов и с образованием частично диссоциированных соединений. В некоторых случаях по положению сингулярной точки на кривой III-го типа удаётся определить стехиометрический состав образовавшегося соединения.
Таким образом, в рефрактометрии двухкомпонентных систем, используется помимо количественного физико-химический метод анализа, который позволяет обнаружить достаточно выраженное взаимодействие компонентов. При отсутствии межмолекулярного взаимодействия, приводящего к ассоциации компонентов, справедливо свойство аддитивности рефракции. В этом случае молярная рефракция раствора RР равна сумме произведений рефракций его компонентов и их мольных долей в этом растворе:
Rp = N1∙R1 + N2∙R2,
где R1 и R2 – молярные рефракции соответственно растворителя и растворённого вещества; N1 и N2 – мольные доли растворителя и растворённого вещества.
Для расчёта RР с использованием экспериментальных данных по уравнению (15) необходимо знать величины "среднемолекулярной массы" раствора, которая определяется соотношением:
Мср = N1∙M1 + N2∙M2,
где M1 и М2 – молекулярные массы компонентов раствора, N1 и N2 - мольные доли компонентов раствора.
Свойством аддитивности, подобно молекулярной рефракции, обладает и удельная рефракция:
![]() (40)
(40)
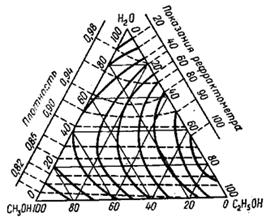
Рис. 5. Треугольная диаграмма для рефрактометрического анализа тройной системы: этиловый спирт - метиловый спирт - вода
4.2 Анализ трёхкомпонентных растворов
Для анализа тройных систем необходимо знать два каких-либо независимых, характеризующих состав системы, параметра. Одним из таких параметров обычно служит показатель преломления, а вторым – как правило, плотность раствора. Состав смеси по значениям этих параметров можно определить графически. Для этого сначала готовят трёхкомпонентные смеси известного состава и строят зависимость "состав – свойство". Зависимость значений показателя преломления и плотности раствора от состава системы представлена на рис. 5. посредством, так называемой тройной диаграммы (треугольник Гиббса – Розебома). Осями координат служат стороны равностороннего треугольника, на каждой из которых откладывается массовая доля бинарной системы, вершины треугольника соответствует 100 % компонентам, а любая точка внутри треугольника определяет состав трехкомпонентной системы. Определив ρ и n стандартных растворов, наносят на диаграмму изоденсы по точкам, соответствующим составам и имеющим одну и ту же плотность, и изорефракты – по точкам, определяющим состав равнопреломляющих смесей. Из окончаний изоденс и изорефракт опускают перпендикуляры на дополнительные шкалы (линии, проведённые параллельно боковым сторонам треугольника), плотности и показатели преломления соответствующие значениям этих величин.
При проведении анализа измеряют плотность и показатель преломления исследуемого образца и определяют точку, отвечающую составу, на пересечении изорефракты изоденсы. Из этой точки проводят линии, параллельные сторонам треугольника, и по отсечённым этими линиями отрезкам определяют состав анализируемой смеси.
Подробно методика построения тройных диаграмм описана в методических указаниях по физической химии "Изучение взаимной растворимости жидкостей в трёхкомпонентных системах" [14].
5. Рефрактометрия полимеров
Рефрактометрический метод достаточно часто применяют при анализе высокомолекулярных соединений. Этот метод впервые был предложен и впоследствии нашёл широкое применение для количественного определения стирола в продуктах его сополимеризации с дивинилом (1,3-бутадиен). Методика [9] позволяет с погрешностью до 5 % установить число содержащихся в сополимерах звеньев дивинила, присоединённых в положения 1-2, а также температуру стеклования таких полимеров с погрешностью до 3–4 0С.
Рефрактометрический метод применяется и для исследования кристаллизуемости хлоропреновых каучуков. При помощи этого метода можно определить степень кристалличности образцов полихлоропрена, закристаллизованных при разных температурах [8].
При переходе от одного углеводородного полимера к другому поляризуемость молекулы существенно не меняется, однако замена атомов водорода на атомы галогенов приводит к изменению поляризуемости полимеров и соответственно к изменению их показателя преломления
Рефрактометрия является простым и удобным методом исследования процессов кристаллизации и плавления полимеров, подвергшихся кристаллизации в различных температурных условиях.
Таблица 6 Показатели преломления полимеров
|
Полимер |
N |
|
Политетрафторэтилен (тефлон) |
1,35 – 1,38 |
|
Полихлорфторэтилен |
1,39 – 1,43 |
|
Ацетат целлюлозы |
1,46 – 1,50 |
|
Поливинилацетат целлюлозы |
1,47 – 1,49 |
|
Полиметилметакрилат |
1,48 – 1,49 |
|
Полипропилен |
1,49 |
|
Поливиниловый спирт |
1,49 – 1,53 |
|
Фенолформальдегидный полимер |
1,50 – 1,70 |
|
Полиизобутилен |
1,51 |
|
Полиэтилен |
1,51 |
|
Натуральный каучук (полиизопрен) |
1,519 |
|
Синтетический каучук (полиизопрен) |
1,522 |
|
Полибутадиен |
1,520 |
|
Полиамид |
1,54 |
|
Поливинилхлорид (ПВХ) |
1,54 – 1,56 |
|
Полистирол |
1,59 – 1,60 |
|
Поливинилиденхлорид |
1,60 – 1,63 |
