Рефрактометрический метод анализа в химии
Таким образом, в электрическом поле образуется диполь с наведённым или как его называют индуцированным дипольным моментом.
Если любую полярную молекулу поместить в электрическое поле, то будут происходить два процесса. Во-первых, молекула будет ориентироваться вдоль поля, и, во-вторых, расстояние между центрами "тяжести зарядов будет увеличиваться, увеличивая дипольный момент молекулы".
Таким образом, полярные молекулы в электрическом поле так же, как и неполярные испытывают деформационную поляризацию. Кроме того, под влиянием электрического поля они ориентируются вдоль его силовых линий, стремясь принять устойчивое положение, отвечающее минимуму потенциальной энергии. Это явление, называемое ориентационной поляризацией, даёт эффект, эквивалентный увеличению поляризуемости молекулы на величину αор, называемую ориентационной поляризуемостью:
![]() (13)
(13)
где k – постоянная Больцмана (1,380662(44)∙10−23 Дж/К);
Т – абсолютная температура, К.
Таким образом, полная поляризуемость молекулы α складывается из трёх величин:
α = αэл + αат + αор или α = αD + αор (14)
Из уравнений (11) и (12) следует, что полная поляризуемость α будет иметь размерность объёма [см3 или Å3].
2.1.1 Молярная поляризуемость
В электрическом (электромагнитном) поле молекулы поляризуются и возникает состояние напряжённости, характеризуемое величиной диэлектрической проницаемости (ε) вещества, которая входит в уравнение закона Кулона и может быть определена экспериментально.
Измеряя диэлектрическую проницаемость, характеризующую вещество в целом, можно определить по теории поляризации диэлектриков электрооптические параметры его молекул, связанные с ε формулой Клаузиуса-Моссотти:
![]() , (15)
, (15)
где NA – число Авогадро;
М – молекулярная масса вещества;
Ρ – плотность вещества, г/мл.
РМ – молярная поляризация – величина, характеризующая меру индуцированного момента в объёме, который занимает 1 моль вещества.
Молярная поляризация, дипольный момент и общая поляризуемость молекулы связаны друг с другом уравнением Дебая, которое выводится из уравнений (12) – (14):
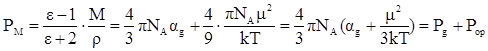 (16)
(16)
По уравнению Дебая можно вычислить значения α и μ по известным величинам ε, М и ρ.
Поляризация молекул веществ, имеющих сравнительно большие значения ε и Р (например Н2О, HCN, HCl), зависит от температуры, уменьшаясь при её повышении. Молекулы таких веществ, не имея центра симметрии зарядов, являются постоянными диполями. Для них молярная поляризация в уравнении Дебая выражается линейной функцией от 1/Т:
![]() , (17)
, (17)
Где
![]() и
и ![]() .
.
Вещества с μ = 0 состоят из симметричных молекул (например О2, СО2, СS2, молекулы многих углеводородов). В электрическом поле в таких молекулах возникает индуцированный дипольный момент. Поляризация молекул этого типа не зависит от температуры (рис. 3).
Для случая молекул постоянных диполей (прямая а; рис. 3) отрезок ординаты ОА = а определяет величину поляризуемости α, а tgβ = b – величину дипольного момента μ
Полная поляризация молекул может наблюдаться или в статическом электрическом поле, или в электромагнитном поле низкой частоты, но не в поле высокой частоты, где диполи не успевают ориентироваться. Поэтому, например, в поле низкочастотного инфракрасного излучения происходит и электронная, и атомная поляризация, а в более высокочастотном поле видимого света – только электронная поляризация (Рэл = 4/3πNАαэл), т.к. при высокочастотных колебаниях успевают смещаться только очень лёгкие частицы – электроны. Для неполярных веществ: РОР = 0 и Р = РД ≈ РЭЛ.
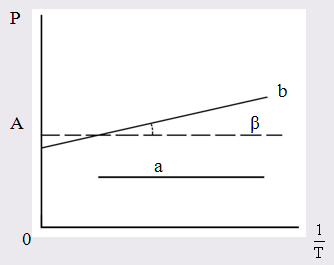
Рис. 3. Зависимость молярной поляризации
от обратной температуры
а – для молекулы, постоянных диполей;
b – для неполярных молекул.
2.2 Молярная рефракция
Из электромагнитной теории света Максвелла следует, что для длин волн, значительно удалённых от области их поглощения молекулами вещества, справедливо равенство:
![]() , (18)
, (18)
где n∞ - показатель преломления света для определённых длин волн.
С учётом этого уравнение Клаузиуса-Мосотти (15) принимает следующий вид:
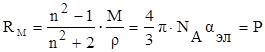 [ см3/(г·моль)] (19)
[ см3/(г·моль)] (19)
Из полученного выражения видно, что показатель RМ, называемый молярной рефракцией, имеет размерность объёма молекул, содержащихся в 1 моль вещества.
Уравнение (15), которое носит название уравнения Лорентца - Лоренца, выведено в 1880 г. независимо друг от друга Х. Лорентцем и Л. Лоренцем.
На практике часто пользуются показателем удельной рефракции r, то есть рефракцией одного грамма вещества. Удельная и молярная рефракции связаны соотношением: R = r∙M, где М молярная масса.
Поскольку в уравнении (19) N пропорционально плотности, то его можно представить в следующем виде:
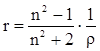 [ см3/г] (20)
[ см3/г] (20)
Х. Лорентц и Л. Лоренц вскрыли физический смысл понятия рефракции – как меры электронной поляризуемости и подвели под учение о рефракции прочный теоретический фундамент.
Величина удельной рефракции практически не зависит от температуры, давления и агрегатного состояния вещества.
В исследовательской практике кроме молярной и удельной рефракции RМ и r используют и другие производные от показателей преломления n (табл. 2).
Показатель преломления неполярных веществ практически не зависит от частоты волн света и поэтому уравнение (19) справедливо при всех частотах. Например, для бензола n2 = 2,29 (длина волны 289,3 нм), тогда как ε = 2,27. поэтому, если для приближённых расчётов рефракции достаточно пользоваться показателем преломления видимого спектра, то для точных расчётов необходимо производить экстраполяцию по формуле Коши:
nλ = n∞ + a/λ2, (21)
где nλ – показатель преломления при длине волны λ;
а – эмпирический коэффициент.
Таблица 2 Рефрактометрические константы
|
N |
Наименование |
Обозначение |
Область применения |
|
1 |
Показатель преломления |
n |
Характеристика чистоты веществ. Анализ двойных систем веществ |
|
2 |
Удельная рефракция |
r |
Характеристика чистоты веществ. Определение концентрации веществ |
|
3 |
Молекулярная рефракция |
R |
Определение значений некоторых атомных и молекулярных констант. Определение строения органических молекул |
|
4 |
Относительная дисперсия |
σ |
Анализ сложных смесей. Определение строения органических молекул |
