Рефрактометрический метод анализа в химии
Рефрактометрия была первым из физических методов, широко применявшихся для определения структуры органических соединений и в течение многих десятилетий (до начала применения ИК – спектроскопии в сороковых годах ХХ века) играла ведущую роль. В настоящее время она применяется в качестве легко доступного источника предварительной информации, дополняющей данные других методов.
3.2 Оптическая экзальтация
Отклонение рассчитанных величин R от экспериментальных примерно до 1 %, обусловлено тем, что средние величины рефракций связей не дают в сумме строго аддитивно молярную рефракцию. Значительно большие отклонения (до 10 %) могут встречаться в случае молекул, содержащих сопряжённые кратные связи. Поскольку наблюдаемая величина R больше рассчитанной, то это явление называется оптической экзальтацией и обозначается как ER. Экзальтация указывает на наличие в молекуле сопряжённых кратных связей, например:
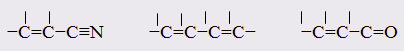
В молекулах с подобными фрагментами π-электронное облако делокализовано по всем атомам, образующим систему сопряжённых связей, и может свободно перемещаться вдоль этой системы, то есть обладает высокой подвижностью. Такое электронное облако легко смещается под действием электрического поля, благодаря чему молекула проявляет повышенную поляризуемость, и наблюдается оптическая экзальтация.
Степень экзальтации, возрастая с увеличением длины цепи сопряжения, указывает на повышение подвижности электронов, их поляризуемость, например, в системах:
![]()
Оптическая экзальтация встречается и в случае замещённых бензолов. Заместители, обладающие положительным электромерным эффектом (+Е – эффектом), обуславливают экзальтацию, которая уменьшается в ряду
NR2 > NH2 > OR > OH > галогены. Это объясняется увеличением поляризуемости молекулы, возникающей за счёт сопряжения свободной пары электронов с π-электронным секстетом бензольного кольца, которое дополнительно облегчается в случае групп NR2 и öR наличием электронодонарных алкилов. Способность −Е – групп, таких как NO2, C=O, C≡N, увеличивать подвижность π-электронов бензольного кольца проявляется в экзальтации, наблюдаемой для нитробензола С6Н5NO2, ацетофенона С6Н5СОСН3, бензонитрила С6Н5С≡N и др. Алкильные группы также увеличивают молекулярную рефракцию за счёт +Е – эффекта.
Таким образом, в области видимого света поляризуемость молекул практически полностью обусловлена смещением π-электронов, и поэтому для органических соединений она равна сумме эффективных смещений отдельных электронов. Последнее обстоятельство придаёт молекулярной рефракции свойство аддитивности для составляющих фрагментов молекулы, что находит широкое применение при определении состава и строения молекул.
3.3 Дисперсия молекулярной рефракции
Дисперсией рефракции называется зависимость рефракции или показателя преломления света от длины волны. При нормальной дисперсии показатель преломления n возрастает с уменьшением длины волны. Дисперсию можно охарактеризовать, как разность значений рефракции одного и того же соединения при двух различных длинах волн α и β (Rα – Rβ). Однако обычно в качестве меры дисперсии используют безразмерную величину – относительную дисперсию:
![]() (34)
(34)
где nF, nC, nD – показатели преломления, измеренные для F – C – линий спектра водорода. F (λ = 486,1 нм), С (λ = 656,3 нм) и D спектра натрия (λ = 589,3 нм), (см. табл. 1).
Относительная дисперсия весьма чувствительна к наличию и положению кратных связей в молекуле. Например, для алифатических парафинов ωFCD ≈ 17−18, а для бензола ωFCD = 33,3. Это позволяет по величине дисперсии и показателю преломления определить принадлежность углеводорода к тому или иному классу соединений и предположить его возможное строение.
3.4 Рефракция и размеры молекул
Рефракцию можно использовать для вычисления не только электронной поляризуемости молекулы или иона (по уравнению 19), но и для расчёта эффективного радиуса частицы (атома, иона). Поскольку рефракция имеет размерность объёма, отнесённого к определённому количеству вещества (удельная – к одному грамму, молярная – к одному молю), то можно (условно) рассматривать молекулу как сферу с радиусом rм и проводящей поверхностью. В этом случае:
αэл = rМ.
Тогда из уравнения (19) получим:
![]() (35)
(35)
откуда:
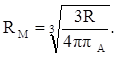 (36)
(36)
4. Рефрактометрия растворов
Аддитивность рефракции характерна и для жидких смесей (растворов). Рефракция смеси равна сумме рефракций компонентов, отнесённых к их долям в смеси.
Молярную и удельную рефракции двухкомпонентной смеси можно соответственно представить в виде следующих уравнений:
R = N1R1 + (1 – N1) R2 (37)
r = w1r1 + (1 – w1) r2, (38)
где N1, N2 и w1, w2 – соответственно мольная и массовая доли первого и второго компонентов.
Уравнения (37) и (38) используются для определения состава смеси и рефракции её компонентов.
Рефрактометрия достаточно широко применяется для идентификации веществ, а также для оценки степени их чистоты. При идентификации, а также определении чистоты веществ критерием служит совпадение показателей преломления исследуемого образца и заведомо известного чистого соединения. Важно, чтобы все измерения n выполнялись при одинаковой температуре и при одних и тех же длинах волн.
Если образец загрязнён, то его можно рассматривать как разбавленный раствор примесей в исследуемом соединении. При этом в случае незначительного содержания примесей их концентрацию Сх можно определить, воспользовавшись линейным соотношением:
![]() (39)
(39)
где n и nчист. – показатели преломления образца и чистого вещества;
К – коэффициент, определяемый экспериментально.
Для ориентировочной оценки величину Сх можно определить, исходя из аддитивности показателей преломления. Чувствительность этого метода тем выше, чем сильнее различаются показатели преломления примесей и чистого органического соединения. Рефрактометрический метод иногда применяется для контроля за процессом очистки вновь синтезированных органических соединений, показатели преломления которых ещё не известны. Если при очистке образца различными способами показатель преломления от одной очистки к другой продолжает изменяться, то органическое соединение не считают чистым (индивидуальным), и процесс очистки продолжают.
4.1 Анализ двухкомпонентных растворов
По значению показателя преломления бинарного раствора можно определить его концентрацию. Для этого необходимо, чтобы была известна зависимость показателя преломления от состава раствора. Для ряда растворов (например, сахарозы, некоторых спиртов, кислот, оснований, солей) зависимости показателей преломления установлены и сведены в таблицы, которыми и пользуются при количественном анализе. Если таких таблиц нет, то используют градуировочные графики, которые строят по результатам измерений эталонных растворов.
