Термодинамика химической и электрохимической устойчивости сплавов системы Ni-Si
![]() ; (1.4)
; (1.4)
то получится представление функции ![]() полиномом. В свою очередь, каждый из параметров
полиномом. В свою очередь, каждый из параметров ![]() ,
, ![]() ,
, ![]() ,…,
,…, ![]() может зависеть от температуры:
может зависеть от температуры:
![]() ; (1.5)
; (1.5)
Многочлены (1.4) и (1.5) - приближенное выражение неизвестной функции ![]() . Качество приближения определяется величиной остатка рядов - той ее части, которая отбрасывается. Чтобы наше приближение удовлетворительно описывало термодинамические свойства раствора, нужно, чтобы остаток был невелик по сравнению с ошибкой экспериментов. Тогда дальнейшее уточнение функции теряет смысл.
. Качество приближения определяется величиной остатка рядов - той ее части, которая отбрасывается. Чтобы наше приближение удовлетворительно описывало термодинамические свойства раствора, нужно, чтобы остаток был невелик по сравнению с ошибкой экспериментов. Тогда дальнейшее уточнение функции теряет смысл.
Как показывает математическая обработка экспериментальных данных, для бинарных растворов достаточно трех параметров ![]() ,
, ![]() ,
, ![]() , чтобы в большинстве случаев корректно аппроксимировать термодинамические функции смешения системы. Поэтому концентрационную (конфигурационную) энергию взаимообмена компонентов в дальнейшем будем представлять тремя членами ряда (1.4), а избыточную энергию Гиббса любой фазы с областью гомогенности будем описывать уравнением:
, чтобы в большинстве случаев корректно аппроксимировать термодинамические функции смешения системы. Поэтому концентрационную (конфигурационную) энергию взаимообмена компонентов в дальнейшем будем представлять тремя членами ряда (1.4), а избыточную энергию Гиббса любой фазы с областью гомогенности будем описывать уравнением:
![]() ; (1.6)
; (1.6)
где ![]() и
и ![]() - термодинамические характеристики областей регулярности двойной системы вблизи чистых компонентов;
- термодинамические характеристики областей регулярности двойной системы вблизи чистых компонентов;
![]() - параметр, учитывающий отклонение от "регулярности".
- параметр, учитывающий отклонение от "регулярности".
Умножив части уравнения (1.6) на общее число молей ![]() компонентов в растворе, получим избыточную энергию Гиббса
компонентов в растворе, получим избыточную энергию Гиббса ![]() произвольного количества фазы. Откуда:
произвольного количества фазы. Откуда:
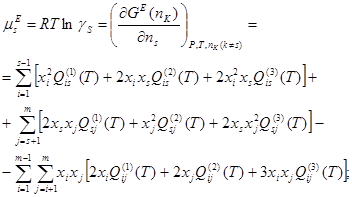 (1.7)
(1.7)
Активности компонентов двойной системы:
![]() ; (1.8)
; (1.8)
![]() ; (1.9)
; (1.9)
Обобщенная теория "регулярных" растворов позволяет успешно описать термодинамические свойства металлических, неметаллических и смешанных систем [5].
сплав кремний никель интерметаллид
1.4 Моделирование термодинамических свойств системы Ni-Si
Для описания термодинамических свойств фаз переменного состава твердых растворов применялась обобщенная теория "регулярных" растворов в однопараметрическом приближении.
Энергетические параметры γ-фазы (Ni) определялись из условия равновесия интерметаллида Ni3Si с твердым раствором:
![]() ; (1.10)
; (1.10)
![]() ; (1.11)
; (1.11)
![]() ; (1.12)
; (1.12)
![]() ; (1.13)
; (1.13)
![]() ; (1.14)
; (1.14)
![]() ; (1.15)
; (1.15)
Комбинируя реакции, получим:
![]() ; (1.16)
; (1.16)
![]() ; (1.17)
; (1.17)
Величины энергия образования реакций (1.14) и (1.15):
![]() ;
;
![]() ;
;
![]() кДж/моль.
кДж/моль.
Отсюда:
![]() ,
,
![]()
![]()
![]()
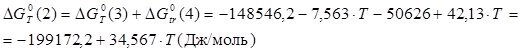
В рамках однопараметрического приближения теории "регулярных" растворов:
![]() ,
,
![]() ; (1.18)
; (1.18)
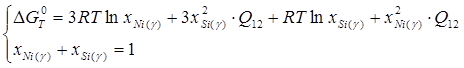 ; (1.19)
; (1.19)
Мольные доли компонентов и температуру определили из диаграммы состояния системы Ni-Si. Они представлены в табл.1.3:
Таблица 1.3
Состав γ-фазы по диаграмме состояния Ni-Si
|
T, 0С |
T, К |
xSi (γ) |
xNi (γ) |
|
793 |
1066 |
0,100 |
0,900 |
|
821 |
1094 |
0,105 |
0,895 |
|
870 |
1143 |
0,110 |
0,890 |
|
910 |
1183 |
0,115 |
0,885 |
|
933 |
1206 |
0,120 |
0,880 |
|
953 |
1226 |
0,125 |
0,875 |
|
974 |
1247 |
0,130 |
0,870 |
|
988 |
1261 |
0,135 |
0,865 |
|
1005 |
1278 |
0,140 |
0,860 |
|
1020 |
1293 |
0,145 |
0,855 |
|
1033 |
1306 |
0,150 |
0,850 |
