Термодинамика химической и электрохимической устойчивости сплавов системы Ni-Si
Для остальных трехфазных равновесий расчет производился тоже исходя из константы равновесия. Например, для равновесия IV:
![]()
Мольные доли компонентов равны единице, поэтому выражение для константы равновесия упрощается:
![]()
![]() ; (2.11)
; (2.11)
Результаты расчетов приведены в таблице 2.5.
Таблица 2.5.
Характеристики фазовых равновесий системы Ni-Si-O при 25 0С
|
№ |
Равновесие |
|
Равновесный состав фаз |
|
I |
Si (γ) - NiSi2 - SiO2 |
1,07*10-156 |
|
|
II |
NiSi2 - NiSi - SiO2 |
3,35*10-150 |
|
|
III |
NiSi - Ni3Si2 - SiO2 |
1,48*10-144 |
|
|
IV |
Ni3Si2 - Ni2Si - SiO2 |
2,00*10-135 |
|
|
V |
Ni2Si - Ni3Si - SiO2 |
1,27*10-128 |
|
|
VI |
Ni3Si - γ-фаза - SiO2 |
3,04*10-129 |
|
|
VII |
γ - фаза - Ni2SiO4 - SiO2 |
2,44*10-81 |
|
|
VIII |
γ - фаза - Ni2SiO4 - NiO |
8,68*10-75 |
|
|
IX |
Ni2SiO4 - NiOх, 1<x<1,346 |
0,21 |
|
|
X |
Ni2SiO4 - SiO2 - NiOx, 1,346<x<1,903 |
0,21 |
|
|
XI |
NiO1,903 - NiO2 - SiO2 |
9,48*1030 |
|
б) Расчет равновесия NiOx - Ni2SiO4 - SiO2
Окисление Ni2SiO4 на воздухе завершится образованием фазы NiOx. Для нахождения значения x решим уравнение:
![]() ; (2.12),
; (2.12), ![]()
![]() ; (2.13)
; (2.13)
![]() ; (2.14)
; (2.14)
Чтобы знать в явном виде зависимость ![]() от х воспользуемся функциональной зависимостью между стандартной энергией образования оксидов данного металла из элементов и стехиометрическим составом оксидов:
от х воспользуемся функциональной зависимостью между стандартной энергией образования оксидов данного металла из элементов и стехиометрическим составом оксидов:
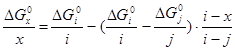 ; (2.15),
; (2.15),
где i, j - степени окисленности оксидов металла, для которых существуют наиболее достоверные термодинамические данные,
х - степень окисленности неизвестного оксида.
Наиболее достоверные термодинамические данные для никеля получены для оксида NiO:
![]()
Данные для оксида Ni2O3 получены расчетным путем: ![]() . Поскольку для гипотетического оксида NiO1,5 энергия Гиббса образования вдвое меньше, то
. Поскольку для гипотетического оксида NiO1,5 энергия Гиббса образования вдвое меньше, то ![]() . Таким образом,
. Таким образом, ![]() ,
, ![]() ,
, ![]() , i=1, j=1,5 и энергия Гиббса оксида NiOx:
, i=1, j=1,5 и энергия Гиббса оксида NiOx:
![]() ; (2.16)
; (2.16)
Подставляя (2.3.13) в (2.3.12) и полученное выражении для ![]() в (2.3.11), находим значение x, соответствующее максимальной степени окисленности никеля в оксиде, полученного окислением Ni2SiO4 на воздухе: х=1,903.
в (2.3.11), находим значение x, соответствующее максимальной степени окисленности никеля в оксиде, полученного окислением Ni2SiO4 на воздухе: х=1,903.
Из результатов расчета следует, что химическое сродство кремния к кислороду намного выше, чем у никеля. Вплоть до содержания кремния в γ - фазе - 10-40 моль единственной оксидной фазой (продуктов окисления сплава) является кремнезем. Окисление сплавов начинается при давлении кислорода большем чем 10-156 атм, поэтому сплавы будут окисляться кислородом воздуха при 250 С. Так как для образования NiO2 требуется давление кислорода в газовой фазе над сплавом большее, чем 9,48*1030, то при окислении сплавов кислородом воздуха NiO2 образовываться не будет. Окисления никеля завершится образованием фазы NiOx.
2.4 Расчет диаграммы состояния системы Ni-Si-H2O при 250С. Анализ химической устойчивости
Диаграммы рН-потенциал строят, зафиксировав активности компонентов, находящихся в растворе. В данной работе построены диаграммы рН-потенциал для системы Ni-Si-H2O при активностях ионов в растворе равных 1 ![]() , 10-3
, 10-3 ![]() , 10-6
, 10-6 ![]() . Они представлены соответственно на рис.2.3, 2.4, 2.5 Основные химические и электрохимические равновесия указаны в табл.2.6.
. Они представлены соответственно на рис.2.3, 2.4, 2.5 Основные химические и электрохимические равновесия указаны в табл.2.6.
