Термодинамика химической и электрохимической устойчивости сплавов системы Ni-Si
Таблица 2.2.
Стандартные энергии Гиббса образования некоторых соединений
|
Соединение |
|
Соединение |
|
|
SiO2 |
918,472 |
Ni (г. ц. к.) |
8,878 |
|
Ni2SiO4 |
1317,270 |
O2 (г) |
61,107 |
|
NiO (т) |
250,695 |
Таблица 2.3.
Стандартные электродные потенциалы
|
№ |
Электродная реакция |
Равновесный потенциал, В |
|
a |
|
0,186-0,0591рН |
|
b |
|
1,219-0,0591рН |
2.1 Согласование и прогнозирование свойств системы Ni-Si в области низких температур
В разделе 1.4 нами была получена модель термодинамических свойств системы Ni-Si, которая описывалась с помощью обобщенной теории "регулярных" растворов в однопараметрическом приближении. Проверяем адекватность полученной модели, решая обратную задачу: рассчитываем мольные доли компонентов раствора, задавая температуру, энергию Гиббса и рассчитанные нами энергии смешения Q12 по уравнениям (1.20) и (1.21). При этом экстраполируем зависимость до комнатных температур. На рис.2.1 точками обозначены исходные данные из диаграммы Ni-Si, а сплошной линией показана полученная модель.
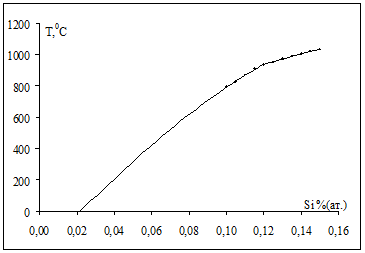
Рис.2.1 Проверка адекватности модели.
Как видно из графика, при 00С растворимость Si в Ni составляет около 0,022 % (ат.).
2.2 Расчет активностей компонентов системы Ni-Si при 250С
В соответствии с обобщенной теорией "регулярных" растворов, активности компонентов двойной системы можно рассчитать по следующим уравнениям:
![]() ; (2.1)
; (2.1)
![]() ; (2.2)
; (2.2)
В рамках однопараметрического приближения теории "регулярных" растворов и непосредственно для системы Ni-Si эти уравнения перепишутся следующим образом:
![]() ,
,
![]() .
.
Результаты расчетов предоставлены в таблице 2.4.
Таблица 2.4.
Состав и активности компонентов системы Ni-Si при 250С
|
Компонент |
xi |
|
|
Si |
0,0228 |
7,370*10-29 |
|
Ni |
0,9772 |
0,9394 |
2.3 Расчет диаграммы состояния системы Ni-Si-O при 25 0С. Анализ химической устойчивости
Как следует из экспериментальных данных по системе никель-кремний (рис.1.1), никель-кислород (рис.1.3) и кремний-кислород (рис.1.4) схема фазовых равновесий в системе никель-кремний-кислород при 298 К и 1 атм. имеет вид (рис.2.2).
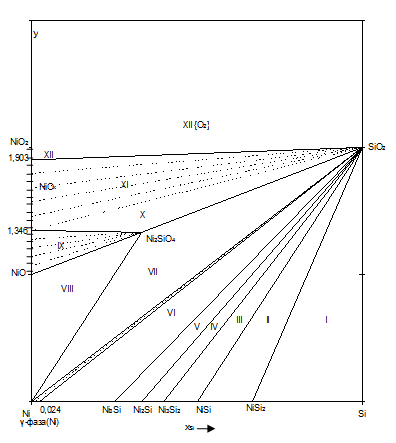
Рис.2.2 Фазовая диаграмма состояния системы Ni-Si-O при 25 0С.
Поскольку химическое сродство кремния к кислороду выше, чем никеля, то можно предположить, что почти при любом составе сплава Ni-Si в первую очередь будет реализовываться равновесие сплав - SiO2.
На диаграмме 2.2 можно выделить области, в которых присутствуют следующие фазы:
1. Si (γ) - NiSi2 - SiO2; (I)
2. NiSi2 - NiSi - SiO2; (II)
3. NiSi - Ni3Si2 - SiO2; (III)
4. Ni3Si2 - Ni2Si - SiO2; (IV)
5. Ni2Si - Ni3Si - SiO2; (V)
6. Ni3Si - γ-фаза - SiO2; (VI)
7. γ - фаза - Ni2SiO4 - NiO; (VII)
8. γ-фаза - Ni2SiO4 - NiO; (VIII)
9. Ni2SiO4 - NiOх, 1<x<1,346; (IX)
10. Ni2SiO4 - SiO2 - NiOx, 1,346<x<1,903; (XI)
Примеры расчета:
а) Фазовое равновесие VII:
γ-фаза - Ni2SiO4 - SiO2 было описано независимыми реакциями образования SiO2 и Ni2SiO4 из компонентов γ-фазы (Ni, Si) и компонентов газовой фазы O2:
(1) ![]() ;
;
(2) ![]() ;
;
![]()
![]()
Константы равновесия реакций 1 и 2:
![]() ; (2.3),
; (2.3), ![]() ; (2.4)
; (2.4)
Для определения состава γ-фазы исключим ![]() из конечного термодинамического уравнения. Для этого возведем уравнение (2.3) в квадрат и поделим полученное на уравнение (2.4), получим:
из конечного термодинамического уравнения. Для этого возведем уравнение (2.3) в квадрат и поделим полученное на уравнение (2.4), получим:
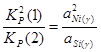 ; (2.5)
; (2.5)
Это уравнение можно переписать в виде:
![]() ; (2.6)
; (2.6)
Из уравнения изотермы химической реакции:
![]() ; (2.7)
; (2.7)
уравнение (2.3.4) можно переписать:
![]() ; (2.8)
; (2.8)
Данное трансцендентное уравнение можно решить только численным методом. Обозначив xSi=x, xNi=x-1, получим:
![]() ; (2.9)
; (2.9)
![]() ; (2.10)
; (2.10)
Подставив уравнения (2.9) и (2.10) в (2.8) решаем численным методом, находим значение х. Исходя из уравнений (2.3) или (2.4) определяем величину ![]() .
.
