Термодинамика химической и электрохимической устойчивости сплавов системы Ni-Si
Решая систему уравнений (1.19), получаем значения энергий смешения (табл.1.4). Q12<0, следовательно, раствор имеет отрицательные отклонения от закона идеальности.
Таблица 1.4
Энергии смешения для γ-фазы
|
№ |
T, К |
Q12, Дж/моль |
|
1 |
1066 |
-165626,7 |
|
2 |
1094 |
-165257,0 |
|
3 |
1143 |
-163418,7 |
|
4 |
1183 |
-162127,0 |
|
5 |
1206 |
-161927,6 |
|
6 |
1226 |
-161878,5 |
|
7 |
1247 |
-161708,6 |
|
8 |
1261 |
-161963,2 |
|
9 |
1278 |
-161961,2 |
|
10 |
1293, |
-162043,7 |
|
11 |
1306 |
-162211,6 |
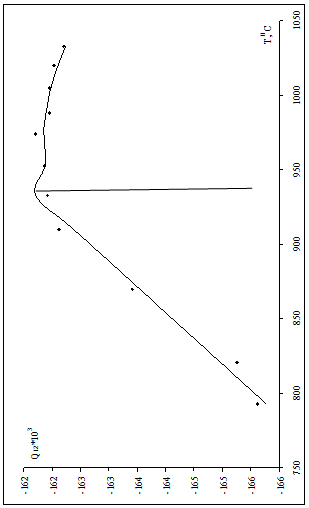
Рис.1.2 Зависимость энергии смешения от температуры.
Строим зависимость энергии смешения от температуры, аппроксимируем полученную функцию по частям (рис.1.2)
в области низких температур при мольной доле кремния 0,1-0,12 функцию зависимости энергии смешения аппроксимировали линейно:
![]() , R2=0,9802; (1.20)
, R2=0,9802; (1.20)
при мольной доле от 0,12 до 0,15 полиномиальная аппроксимация:
![]() , R2=0,8098; (1.21)
, R2=0,8098; (1.21)
1.5 Термодинамические функции образования интерметаллидов
Согласование энергий Гиббса образования бинарных интерметаллидов систем Ni - Si.
В системе Ni-Si при низких температурах термодинамически устойчив твердый раствор кремния в никеле с решеткой г. ц. к., существуют интерметаллидные фазы β1 (Ni3Si), δ (Ni2Si), ε (Ni3Si2), αNiSi2 и NiSi. Стандартные энергии Гиббса образования этих интерметаллидов приведены в таблице 1.5 [6].
Таблица 1.5.
Стандартные энергии Гиббса образования интерметаллидов
|
Соединение |
|
|
β1 (Ni3Si) |
-150,800 |
|
δ (Ni2Si) |
-143,100 |
|
ε (Ni3Si2) |
-232,000 |
|
αNiSi2 |
-94, 200 |
|
NiSi |
-89,600 |
1.6. Фазовые диаграммы состояния систем Ni-O и Si-O
Методы расчета фазовых диаграмм состояния металл-кислород.
Химическая устойчивость металлов в окислительной газовой среде, например, на воздухе, определяется их стойкостью к окислению кислородом. Лучшим способом представления термодинамической информации об окислении металлических материалов являются фазовые диаграммы состояния систем металл-кислород.
На фазовых диаграммах Ме-О представлены различные химические равновесия, играющие роль в процессе окисления металла. Они характеризуют растворимость кислорода в данном металле, состав оксидных форм, образующихся в результате окислении металла кислородом, и устойчивость фаз в зависимости от различных параметров системы: температуры, давления, состава и др.
Состав системы выражается содержанием металла и кислорода в атомных процентах, либо в процентах по массе.
Для более сложных систем, содержащих третий компонент - другой металл, существуют аналогичные диаграммы состояния Ме1-Ме2-О. Они позволяют разобраться в вопросах состава и структуры окалины (слоев окислов) на поверхности бинарных сплавов. В литературе накоплен огромный справочный материал по термодинамическим свойствам неорганических веществ, сформулированы общие принципы фазовых равновесий в гетерогенных системах (правило фаз Гиббса), предложены различные модели, интерполирующие свойства компонентов и металлических, и оксидных растворов (теории совершенных и "регулярных" растворов) и т.п. Все это позволило расчетным путем выявить вид и характерные особенности интересующих нас диаграмм состояния [7].
Согласно закону равновесия фаз - правилу фаз Гиббса, в трехкомпонентной системе при постоянных внешних параметрах (P,T=const):
f=3-Ф; (1.22)
где f - число термодинамических степеней свободы, или вариантность системы, то есть количество параметров (температура, давление, концентрации компонентов в фазах), которые являются независимыми,
Ф - количество фаз в системе, находящихся в равновесии.
Из физических соображений следует, что f![]() 0. Таким образом, в указанной системе возможны равновесия с участием одной, двух или максимум трех фаз:
0. Таким образом, в указанной системе возможны равновесия с участием одной, двух или максимум трех фаз:
однофазные равновесия (f=2); отдельные фазы (вещества) термодинамически устойчивы в определенном интервале составов и, соответственно, парциальных давлений кислорода;
двухфазные (моновариантные) равновесия (f=1);
трехфазные (нонвариантные) равновесия (f=0).
В условиях трехфазного равновесия система не имеет степеней свободы, т.е. данное состояние системы полностью описывается законами действующих масс гетерогенных химических реакций и условиями нормировки составов фаз. Для однозначного расчета составов фаз в условиях двухфазового равновесия необходимо задаваться одним из параметров системы.
Для записи законов действующих масс (выражений для констант равновесий) химических реакций необходимо определить активности компонентов в фазах. Активность кислорода в газовой фазе при давлении 1 атм может быть принята его парциальному давлению. Для конденсированных фаз в рамках модели регулярных растворов справедливо выражение:
