Термодинамика химической и электрохимической устойчивости сплавов системы Ni-Si
![]() - активность иона в растворе.
- активность иона в растворе.
Введя общепринятое обозначение ![]() , получим:
, получим:
![]() ; (1.28)
; (1.28)
Для того чтобы построить диаграмму рН-потенциал по уравнению (1.28), выбирают фиксированные значения ![]() так, чтобы последний член имел постоянную величину. Затем строят прямую линию с одинаковой
так, чтобы последний член имел постоянную величину. Затем строят прямую линию с одинаковой ![]() при рН=0 и наклоном
при рН=0 и наклоном ![]() . При 25 0С значение
. При 25 0С значение ![]() равно 0,0591 В, тогда наклон прямой равен
равно 0,0591 В, тогда наклон прямой равен ![]() .
.
Наклонные линии (![]() и
и ![]() ) отображают равновесия, в которых участвуют ионы Н+ и ОН - совместно с электронами; горизонтальные линии (m=0) - равновесия, в которых участвуют электроны, но не принимают участия ионы Н+ и ОН-; вертикальные линии (n=0) - равновесия, в которых принимают участие ионы Н+ и ОН-, но не учавствуют электроны. Последнее равновесие является химическим, поэтому не может быть рассчитано по формуле (1.28).
) отображают равновесия, в которых участвуют ионы Н+ и ОН - совместно с электронами; горизонтальные линии (m=0) - равновесия, в которых участвуют электроны, но не принимают участия ионы Н+ и ОН-; вертикальные линии (n=0) - равновесия, в которых принимают участие ионы Н+ и ОН-, но не учавствуют электроны. Последнее равновесие является химическим, поэтому не может быть рассчитано по формуле (1.28).
Вместо него применяют уравнение:
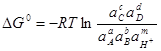 ; (1.29)
; (1.29)
![]() ; (1.30)
; (1.30)
Затем определяют значение рН для вертикальной линии по уравнению:
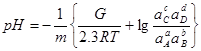 ; (1.31)
; (1.31)
Как ранее упоминалось, на полные диаграммы рН-потенциал наносят семейства линий при активностях ионов в растворе равных 100, 10-2, 10-4, 10-6 моль, соответственно обозначаемые 0, - 2, - 4, - 6.
Для характеристики коррозионных процессов можно использовать упрощенные диаграммы рН-потенциал. Для этого или объединяют отдельные кривые, соответствующие различным активностям (проводят усредненную кривую), в одну, либо строят диаграмму только для одной из активностей ионов в растворе.
Диаграмма рН-потенциал системы Si-H2O и Ni-O
Диаграмма электрохимического равновесия системы Si-H2O представлена на рис.1.5 [7].
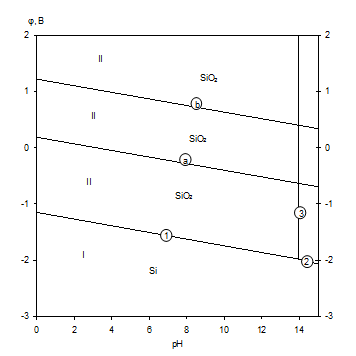
Рис.1.5 Диаграмма рН-потенциал для системы Si-H2O при 25 0С,
1 атм. (воздух) и ![]() =1.
=1.
Линии "а" и "b" на диаграмме ограничивают область термодинамической устойчивости воды. В области 1 кремний находится в виде оксида кремния SiO2.
Основные химические и электрохимические равновесия приведены в таблице 1.6.
Таблица 1.6.
Основные химические и электрохимические равновесия в системе Si-H2O при 25 0С, 1 атм. (воздух) и ai=1
|
№ на рис. |
Электродная реакция |
Равновесный потенциал (В) или рН раствора |
|
a |
(0,01 об. % возд.) |
0,186-0,0591рН |
|
b |
|
1,219-0,0591рН |
|
1 |
|
-1,151-0,0591рН |
|
2 |
|
-0,739-0,0887рН |
|
3 |
|
рН 13,94 |
Линии "а" и "b" на диаграмме ограничивают область термодинамической устойчивости воды. В области 1 кремний находится в виде оксида кремния SiO2.
Диаграмма рН-потенциал системы Ni-H2O приведена на рис.1.6 [10].
На диаграмме можно выделить 4 области преобладания различных фаз:
I - Ni - область иммунности
II - Ni2+ - область активной коррозии
III - NiOx - область пассивности
IV - ![]() - область транспассивности.
- область транспассивности.
Основные химические и электрохимические равновесия указаны в табл.1.7.
Таблица 1.7.
Основные химические и электрохимические равновесия в системе Ni-H2O при 25 0С, 1 атм. (воздух) и ai=1 моль/л (негидратированная форма оксидов)
|
№ линии |
Электродная реакция |
Равновесный потенциал (В) или рН раствора |
|
1 |
|
-0,250 |
|
2 |
|
0,133-0,0591рН |
|
3 |
|
|
|
4 |
|
3,36-0,1182рН |
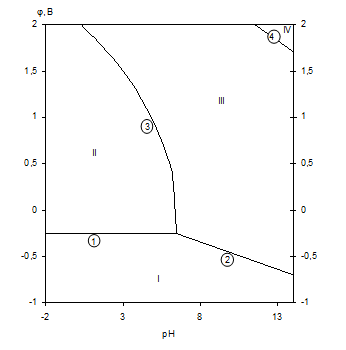
Рис.1.6. Диаграмма рН-потенциал системы Ni-H2O при 25 0С,
1 атм. (воздух) и ![]() =1 моль/л (негидратированная форма оксидов).
=1 моль/л (негидратированная форма оксидов).
2. Экспериментальная часть
Справочные данные для расчетов системы Ni-Si-O [6].
Таблица 2.1.
Стандартные энтальпии образования и энтропии некоторых веществ
|
Элемент или соединение |
|
|
|
Ni (г. ц. к.) |
0 |
7,12 ± 0,05 |
|
O2 (г) |
0 |
49,005 ± 0,008 |
|
NiO (т) |
57,2 ± 0,1 |
9,1 ± 0,1 |
