Термодинамика химической и электрохимической устойчивости сплавов системы Ni-Si
![]() ; (1.23)
; (1.23)
где ![]() - активность компонента в растворе;
- активность компонента в растворе;
![]() - мольная (атомная) доля компонента в растворе;
- мольная (атомная) доля компонента в растворе;
![]() - энергия смешения компонентов при образовании раствора.
- энергия смешения компонентов при образовании раствора.
Формула применима к двухкомпонентным растворам.
Для конденсированных фаз в рамках модели идеального (совершенного раствора) ![]() .
.
Валовый состав тройной системы Ме1-Ме2-О можно записать как
![]() ;
;
где ![]() - атомная доля металла
- атомная доля металла ![]() ;
;
![]() - степень окисленности системы
- степень окисленности системы
(![]() .)
.)
Тогда изотермические сечения диаграммы состояния этой системы удобно представить графически на плоскости в координатах ![]() .
.
В соответствии с теорией химического сродства Вант-Гоффа термодинамическим критерием возможности окисления элементов в сплаве служит стандартное изменение свободной энергии Гиббса ![]() для реакции:
для реакции:
![]() ; (1.24)
; (1.24)
или давление кислорода ![]() . Эти показатели взаимосвязаны уравнением:
. Эти показатели взаимосвязаны уравнением:
![]() ; (1.25)
; (1.25)
Чем отрицательнее величина изобарно-изотермического потенциала реакции (1.24), или ниже ![]() , тем выше избирательность окисления данного металла.
, тем выше избирательность окисления данного металла.
Итак, представление фазовых диаграмм вида Ме-О, Ме1-Ме2-О может быть различно и зависеть от выбора термодинамических параметров как координат (Р, Т составов и др.) Но в любом случае эти диаграммы могут служить термодинамической основой при изучении вопросов об устойчивости систем, в частности, при рассмотрении вопросов об окислении металлов [8].
Фазовая диаграмма состояния системы Si-O
Фазовая диаграмма состояния системы Si-O представлена на рис.1.3 [7]. Как следует из диаграммы, в системе образуется одна устойчивая оксидная фаза - SiO2 (кремнезем). Таким образом, при температурах ниже 14000С в системе реализуются следующие фазовые равновесия:
![]()
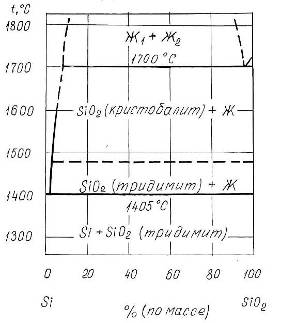
Рис.1.3 Диаграмма состояния системы Si-O.
Фазовая диаграмма состояния Ni-O приведена на рис.1.4 [5].
Из нее следует, что при температурах ниже 200 0С в системе никель - кислород наблюдается следующая последовательность равновесий:
![]()
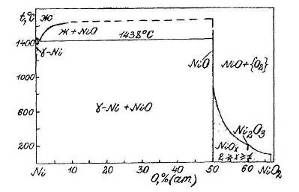
Рис.1.4 Диаграмма состояния Ni - O.
Здесь ![]() - фаза нестехиометрического состава, непрерывный ряд твердых растворов между NiO и NiO2 (1<x<2).
- фаза нестехиометрического состава, непрерывный ряд твердых растворов между NiO и NiO2 (1<x<2).
1.7 Диаграммы электрохимического равновесия систем
Ni-H2O и Si-H2О. Общие положения. Применение диаграммы рН-потенциал. Электрохимическая устойчивость металлов и сплавов определяется их стойкостью к коррозии в водной среде. Лучшим способом представления термодинамической информации о химической и электрохимической устойчивости металлических систем в водных растворах являются диаграммы рН-потенциал. Впервые такие диаграммы в системе элемент-вода для чистых металлов при температуре 250С были построены Марселем Пурбе и использованы им для описания термодинамических коррозионных процессов.
На диаграммах Пурбе представлены различные химические и электрохимические равновесия, играющие роль в процессе коррозии металлов. Они характеризуют прежде всего состав водного раствора и устойчивость твердых фаз в зависимости от двух переменных: электродного потенциала и рН раствора для реально устанавливающихся равновесий. Электродные потенциалы φ выражены в вольтах по водородной шкале.
Диаграммы состоят из областей, разграниченных между собой кривыми равновесия. В случае жидких фаз положение границы зависит от активности не только ионов водорода, но и других ионов, участвующих в равновесии. В таких случаях, вместо одной кривой на рисунке нанесено семейство кривых, каждая из которых отвечает определенной активности соответствующих ионов (при этом для каждой кривой указано значение логарифма активности 0, - 2, - 4, - 6 и т.п.) [5].
На всех диаграммах рН-потенциал наносятся две основные линии диаграммы состояния воды (они наносятся пунктиром и обозначаются буквами а и b). Эти линии отвечают электрохимическим равновесиям воды продуктами ее восстановления - водородом (линия а) и окисления - кислородом (линия b). Область, заключенная между этими двумя линиями, является областью устойчивости воды. При потенциалах, лежащих вне этой области, т.е. выще линии b или ниже линии а, вода термодинамически неустойчива; выше линии b вода окисляется, а ниже линии а - восстанавливается.
Диаграммы Пурбе служат термодинамической основой при решении вопросов об устойчивости того или иного состояния системы и о возможности протекания в ней какой-либо реакции. В частности, ими можно пользоваться при рассмотрении вопросов об окислении металлов (как самопроизвольном, так и анодном) [10].
Методика расчетов диаграмм рН-потенциал
Для расчета и построения диаграмм рН-потенциал необходимо располагать сведениями об основных реакциях (окисления и восстановления, комплексообразования и осаждения), возможных в данной системе, об их количественных характеристиках (энергии Гиббса, произведение растворимости и т.д.) и передать графически в координатах рН-потенциал.
Линии на диаграмме рН-потенциал рассчитываются по равновесию, записанному в общей форме:
![]() ; (1.26)
; (1.26)
для которого можно записать уравнение равновесного потенциала:
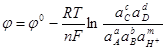 ; (1.27)
; (1.27)
где ![]() - равновесный потенциал системы;
- равновесный потенциал системы;
![]() - стандартный потенциал системы;
- стандартный потенциал системы;
![]() - универсальная газовая постоянная;
- универсальная газовая постоянная;
![]() - постоянная Фарадея;
- постоянная Фарадея;
![]() - температура, К;
- температура, К;
