Химические методы определения сахаров
Реактивы и материалы: а) Реактив Фелинга
20 см3 4 %-ного раствора CuSO4 + 20 см3 щелочного раствора сегнетовой соли {200 г сегнетовой соли растворяют в 500 см3 воды, 150 г едкого натра растворяют в 300 см3. Раствор щелочи осторожно приливают к раствору сегнетовой соли и доводят объем до 1 дм3}.
б) Раствор железоаммиачных квасцов
96 г квасцов растворяют в 500 см3 воды и осторожно по стенке приливают 200 г (108 см3) концентрированной серной кислоты. Объем доводят водой до 1 дм3.
в) 0,1 н. КМпО4
1. Перманганатный метод.
Ход работы:
1.Приготовление вытяжки. Из средней пробы продукта берут навеску, величина которой зависит от предполагаемого содержания сахаров в материале. При исследовании фруктов или ягод навеска составляет 15—50 г мезги (материала, измельченного на терке или мясорубке), варенья, повидла, джема — 7—8 г. При исследовании продуктов, содержащих крахмал (например, клубней картофеля, незрелых яблок и груш), водную вытяжку не нагревают на водяной бане, а сахара извлекают холодной водой в течение 1 ч, часто взбалтывая колбу.
Навеску количественно переносят в мерную колбу на 250 мл, смывая ее дистиллированной водой. Объем навески и воды в колбе не должен превышать 130—150 мл. Колбу встряхивают, затем определяют реакцию содержимого (с помощью нейтральной лакмусовой бумаги или универсального индикатора). При исследовании фруктов и ягод реакция вытяжки обычно бывает кислой, поэтому ее доводят до нейтральной (рН = 7) осторожным добавлением 15%-кого раствора углекислого ратрня (под контролем лакмуса или универсального индикатора), после чего колбу нагревают в течение 15—20 мин, на горячей водяной бане (80°С), часто встряхивая для перемешивания содержимого.
Колбу охлаждают и к вытяжке добавляют 7—15 мл раствора уксуснокислого свинца, взбалтывают и ставят на 5-10 мин. (для осаждения белков, пигментов, дубильных веществ, также обладающих восстанавливающими свойствами). Появление прозрачного слоя жидкости над осадком свидетельствует о полноте осаждения. Если полнота осаждения не была достигнута, в колбу добавляют (каплями) еще 1—5 мл раствора уксуснокислого свинца и взбалтывают. Для осаждения избытка уксуснокислого свинца в колбу приливают 18—20 мл насыщенного раствора двузамещенного фосфорнокислого натрия, взбалтывают и оставляют на 10—12 мин. для отстаивания. Проверяют полноту осаждения свинца, для чего по стенке колбы осторожно приливают 1-—2 капли раствора фосфорнокислого натрия. Если в прозрачном слое жидкости над осадком уже не образуется мути, считают, что полнота осаждения достигнута. Колбу доливают до метки водой, взбалтывают и содержимое ее фильтруют через бумажный складчатый фильтр. В фильтрате (его называют фильтрат А) определяют содержание редуцирующих сахаров. Надо так подобрать навеску продукта и разведение, чтобы концентрация сахаров в сахарном растворе составляла 100 мг.
Быстрого осаждения белковых, красящих и дубильных веществ (так называемых, органических несахаров) можно достигнуть обработкой вытяжки основным азотнокислым свинцом. К 100 мл вытяжки прибавляют 3—4 мл раствора едкого натра, взбалтывают и добавляют 4—6 мл раствора азотнокислого свинца. Осветление раствора происходит в течение 5—7 мин. Для освобождения от избытка свинца к вытяжке, нагретой до температуры 60° С, приливают 3—4 мл насыщенного раствора сернокислого натрия и нагревают на водяной бане при той же температуре 10 мин.
2. Проведение анализа: 20 см3 фильтрата А помещают в коническую колбу на 100 см3 и добавляют 20 см3 реактива Фелинга I и 20 см3 реактива Фелинга II. Содержимое колбы перемешивают и кипятят точно 3 минуты, время замечают с момента появления первых пузырьков. Горячую жидкость из колбы сливают на фильтрующий слой через воронку Бюхнера в колбу Бунзена при слабом отсасывании, стараясь осадок закиси меди не переносить на фильтр. Затем осадок в колбе промывают теплой водой и перерастворяют с помощью железоаммонийных квасцов (10 .15см3), при этом часть сернокислого окисного железа квасцов восстанавливается в закисное:
Cu20 + Fe2(NH4)2(SO4)4 + H2SO4 = 2CuSO4 + 2FeSO4 + (NH4)2SO4 + H2O.
Далее воронку Бюхнера с фильтрующим слоем переносят в чистую колбу Бунзена и содержимое колбы небольшими порциями сливают на фильтр. Осадок на фильтре размешивают стеклянной палочкой до полного растворения. Осадок на фильтре не должен находиться на воздухе во избежание его окисления. Колбу и фильтр промывают теплой дистиллированной водой два раза. Фильтрат сразу титруют 0,1 н раствором перманганата калия до появления розовой окраски (от последней капли), снова окисляющего закисное железо в окисное
2KMnO4 + 10FeSO4 + 8H2SO4 = K2SO4 + 2MnSO4 + 5Fe2 (SO4)3 + 8H2O.
Титр перманганата калия устанавливают по меди, что дает возможность сразу пересчитать количество пошедшего на титрование перманганата калия на эквивалентное количество меди (1 см3 0,1 н. КМпО4 соответствует 6,36 мг меди). Количество сахара, соответствующее данному количеству меди, находят по эмпирическим таблицам.
Количество сахара в процентах вычисляют по формуле:
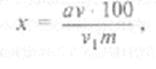
где а — количество сахара в пробе (объем v,); v — объем вытяжки, полученный из навески; vx — проба вытяжки (в см3), взятая на определение; т — масса навески материала, мг.
Перманганатный метод считается арбитражным. Существует также ускоренный—йодометрический — метод.
2.Иодометрический метод (по Шорлю). Фильтрат А кипятят с жидкостью Фелинга (см. выше). Так как жидкость Фелинга берется в избытке, то часть меди окажется невосстановленной и останется в окисной форме. Чтобы определить избыточное количество окисной меди, в охлажденную после кипячения жидкость добавляют раствор йодистого калия и серной кислоты. Происходит реакция
2 CuSO4 + 4 КJ = Cu2J2 + 2 K2SO4 + I2.
Выделившийся молекулярный иод оттитровывают раствором тиосульфата натрия:
2Na2S2O3 + I2 = Na2S4O6 + 2NaI
Для определения количества двухвалентной меди, восстановленной сахаром, проводят контрольный опыт, в котором вместо исследуемого раствора берут дистиллированную воду. По результату контрольного опыта определяют количество тиосульфата натрия, эквивалентное всей двухвалентной меди, участвующей в опыте. По разности объемов раствора тиосульфата натрия, пошедшего на титрование иода после взаимодействия с KI со всей двухвалентной медью (контрольный опыт) и той, что осталась после взаимодействия с редуцирующими сахарами, судят о количестве восстановленной сахаром двухвалентной меди. Данный метод отличается простотой, высокой точностью определения и возможностью определять содержание сахара в довольно широких пределах (от 0,3 до 88,2 мг в 30 мл раствора).
Реактивы и материалы:Хлеб, нож, разделочная доска, дистиллированная вода, 15%-ный раствор ZnSO4, 4%-ный раствор NaOH, 20%-ный раствор НС1, 10%-ный раствор NaOH, индикатор метиленовый красный, 6,925%-ный раствор CuSO4, щелочной раствор сегнетовой соли, KJ, 25%-ный раствор серной кислоты, 0,1 н. раствор Na2S2O3, 1%-ный раствор растворимого крахмала, мерные колбы вместимостью 100, 200, 250 см3, конические колбы вместимостью 200—300 см3, воронки, цилиндры вместимостью 10 см3, бюретки, водяная баня, термометры, титровальная установка, фарфоровая чашечка вместимостью 20 см3, фильтровальная бумага.
