Реакции нуклеофильного замещения
СОДЕРЖАНИЕ
- Введение
- Общие представления о механизмах реакций нуклеофильного замещения
- Стереофимическое течение реакций нуклеофильного замещения.
- Кинетический характер реакций нуклеофильного замещения. .
- Кинетика реакций мономолекулярного замещения.
- Влияние структурных факторов на скорости SN1-реакций
- Электронные факторы
- Стерические факторы
- Участие соседних групп
- Влияние растворителя в реакциях мономолекулярного нуклеофильного замещения
- Соотношение скоростей мономолекулярного замещения и отщепления
- Синхронные нуклеофильные процессы. Бимолекулярное нуклеофильное замещение
- Влияние строения субстрата на реакционную способность в реакциях SN2
- Стерические факторы
- Электронные эффекты заместителей в субстрате
- Природа уходящей группы
- Влияние растворителей на скорость SN2-реакций
- Конкуренция моно- и бимолекулярного замещения.
- Литература
ВВЕДЕНИЕ.
Вообще нужно признать раз навсегда, что не существует «науки для науки», как еще иногда называют у нас теоретическую науку, и что только на основе ее развития возможен быстрый промышленный прогресс.
А. Е. Фаворский.
Процессы, сопровождающиеся гетеролитическим разрывом и образованием ковалентных связей, по типу реагента можно подразделить на нуклеофильные и электрофильные. Мы начнем рассмотрение механизмов реакций нуклеофильных процессов. Можно представить три основных типа таких реакций.
- Диссоциативные процессы. На первой стадии, происходящей без участия нуклеофильного реагента, молекула субстрата превращается в малостабильный интермедиат, который на второй стадии взаимодействует с нуклеофилом. Примерами таких реакций могут служить реакции мономолекулярного замещения и отщепления.
- Ассоциативные процессы. Первоначально происходит взаимодействие молекулы субстрата с нуклеофильным реагентом с образованием интермедиата, который на второй стадии процесса превращается в конечный продукт. К таким реакциям относится большинство реакций замещения в ароматическом ряду, а также реакции нуклеофильного присоединения по кратным связям углерод - углерод и углерод - гетероатом.
Как диссоциативные, так и ассоциативные процессы являются, как минимум, двухстадийными.
- Синхронные процессы. В этом случае конечный продукт образуется из исходного в одну стадию, т. е. разрыв старой связи и образование новой происходят одновременно. Примерами таких реакций являются бимолекулярное нуклеофильное замещение и отщепление, а также реакции переноса протона.
ОБЩИЕ ПРЕДСТАВЛЕНИЯ О МЕХАНИЗМАХ РЕАКЦИИ НУКЛЕОФИЛЬВОГО ЗАМЕЩЕНИЯ.
В общем виде реакцию нуклеофильного замещения можно представить следующей схемой:
R׃X + Y: → R:Y + X׃
В качестве нуклеофильного агента Y может выступать как анион, так и нейтральная молекула, обладающая хотя бы одной неподеленной парой электронов (т. е. основание Льюиса), например:
Y ═ H2O, ROH, H2S, RSH, NH3, OH-, OR-, SH-, SR-, Hal-, CN-, SCN-, NO2-, N3-, RCOO-, RC=CHR и т. д.
│
О
Замещаемая группа Х (называемая уходящей группой) обычно обладает высокой электроотрицательностью и может уходить как в виде аниона, так и в виде незаряженной молекулы, отщепляясь с электронами нарушающейся связи:
Х = Hal, ОН, OR, OSО2R, OCOR, N+R3, S+R2 и т. д.
Следует иметь в виду, что в большинстве случаев реакции нуклеофильного замещения сопровождаются конкурирующими с ними реакциями нуклеофильного отщепления, так как нуклеофильный реагент может взаимодействовать не только с положительно заряженным атомом углерода, но и с атомом водорода, находящимся α-положении, отщепляя его в виде протона.
Реакции нуклеофильного замещения обозначаются как SN, а отщепления - EN. (S-substitution, N-nucleophilic).
Реакция замещения при Csp3 может осуществляться как диссоциативный или как синхронный процесс. В первом случае реакция начинается с мономолекулярной диссоциации по связи С─Х с образованием карбокатиона, который на второй стадии взаимодействует с нуклеофильным реагентом:
![]()
Во втором случае образование связи с нуклеофильным реагентом и разрыв связи с уходящей группой осуществляются одновременно, и процесс идет в одну стадию:
RX + Y- → [Xδ-…R…Yδ-]≠ → RY + X-
Процесс может осуществляться как двухстадийный - за счет первоначальной атаки нуклеофила на молекулу субстрата с образованием пентаковалентного интермедиата, и затем на второй стадии происходит отщепление уходящей группы (хотя имеются указания, что в газовой фазе пентаковалентный анион СХ5 может быть достаточно устойчив, подавляющее большинство исследователей считают, что в реакциях в растворе эта возможность не осуществляется).
О том, что реакции нуклеофильного замещения действительно могут осуществляться по двум различным механизмам, свидетельствуют как стереохимические, так и кинетические данные.
Стереохимическое течение реакций нуклеофильного замещения.
При исследовании реакций нуклеофильного замещения у асимметричного атома углерода было показано, что в зависимости от строения исходных реагентов и условий проведения реакции стереохимическое течение реакции может быть различным. Так, при проведении следующего цикла реакций оптическая активность практически полностью сохраняется, но знак вращения изменяется на противоположный:
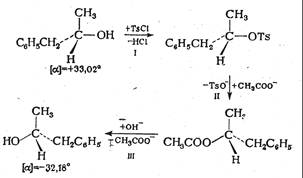 |
На первой и третьей стадиях реакции связи асимметрического атома углерода не затрагиваются (для третьей стадии реакции это было показано методом меченых атомов) и, следовательно, его конфигурация остается неизменной. Отсюда следует, что вторая стадия замещение n-толуолсульфонатной группы на ацетат-анион - происходит с полным обращением конфигурации у реакционного центра (вальденовское обращение).
Аналогичные выводы были сделаны при сравнении скорости рацемизации и обмена галогена в оптически активных галогенпроизводных (поскольку исходное и конечное соединения идентичны, для изучения скорости процесса использовались радиоактивные галоген-ионы).
Если предположить, что каждый акт обмена сопровождается обращением конфигурации, то при прохождении реакции на 50% должен образовываться полностью рацемизованный продукт, т. е. скорость обмена должна быть в два раза меньше скорости рацемизации. Экспериментальные данные полностью согласуются с этим предположением. Таким образом, обмен йода в 2-йодоктане идет с полным обращением конфигурации.
