Реакции нуклеофильного замещения
| Соединение | (CH3)3CBr | |||
| kотн (80%-ной C2H2OH, 250С | 1 | 10-3 | 10-6 | 10-13 |
Из изложенного очевидно, что при увеличении числа углеводородных заместителей при реакционном центре диссоциация должна облегчаться за счет действия как электронных, так и стерических факторов. Поэтому реакции мономолекулярного замещения особенно характерны для третичных систем.
Участие соседних групп.
При рассмотрении факторов, влияющих на стабильность карбкатионов говорилось, что некоторые присутствующие в молекуле группировки способны стабилизировать образующийся ион за счет взаимодействия с катионным центром и, следовательно, должны увеличивать скорость диссоциации. Такое участие соседних групп называется анхимерным содействием (от греческих слов анхи - близкий и мерос - часть). В результате анхимерного содействия образуется циклическая структура, и на второй стадии процесса нуклеофил атакует карбкатион с той же стороны, где находилась уходящая группа. В результате реакции, идущие с анхимерным содействием, как правило, сопровождаются сохранением конфигурации при реакционном центре. Например, конфигурация сохраняется при метанолизе солей α-бромпропионовой кислоты, что, по мнению Грюнвальда и Уинстейна, обусловлено промежуточным образованием α-лактона:
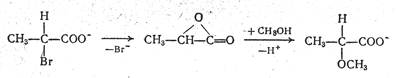
Если реакция ведется в спирте, то для образования α-лактона необходима десольватация карбоксилатной анионной группы. Поэтому при переходе от спирта к диметилсульфоксиду, где карбоксилатная анионная группа сольватирована слабее, скорость реакции увеличивается, что отличает рассматриваемую реакцию от большинства SN1-процессов, которые идут с большими скоростями в протонных растворителях.
Анхимерное содействие могут проявлять и другие заместители, обладающие неподеленными парами электронов (атомы галогенов, алкоксигруппы). Эффективность содействия зависит от величины образующегося цикла и максимальна для пяти- и шестичленных циклов.
За счет анхимерного содействия катион может быть стабилизирован в такой степени, что мономолекулярная реакция идет даже в случае первичных производных. Так, в реакции
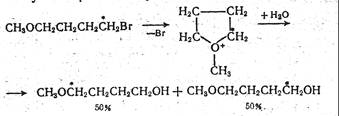
метка в конечном продукте поровну распределена между двумя атомами углерода, что свидетельствует о промежуточном образовании симметричного оксониевого катиона.
Аналогично осуществляется анхимерное содействие за счет атома серы. При этом один и тот же промежуточный сульфониевый катион может быть получен из соединений, различающихся построению, которые, таким образом, будут давать одни и те же конечные продукты:
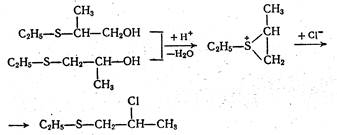
Как и следовало ожидать, скоростьопределяющей стадией является образование циклического катиона. Чем менее стабилен образующийся катион, тем больше вклад анхимерного содействия в его стабилизацию, т. е. он должен быть значительно больше в случае первичных систем, чем в случае вторичных. У третичного центра, как правило, анхимерное содействие не осуществляется как за счет большей стабильности третичных карбкатионов, так и вследствие стерических затруднений. Только в некоторых наиболее благоприятных случаях удается обнаружить участие соседних группировок в стабилизации третичного карбкатионного центра. Увеличение стабильности третичного катиона приводит к уменьшению роли анхимерного содействия.
Весьма сложным является вопрос о возможности участия арильных заместителей в стабилизации карбкатионного центра. Возможность проявления анхимерного содействия сильно зависит от природы субстрата и типа реакции. Наличие анхимерного содействия арильными заместителями может быть установлено при помощи изучения стереохимии процесса, а также влияния растворителя. В большой серии работ Шлейер показал, что реакция может идти по двум путям: с анхимерным содействием (при этом отсутствует нуклеофильное содействие растворителя) и без него. Оба пути осуществляются одновременно, и их соотношение зависит как от структуры субстрата, так и от условий проведения реакции.
Влияние растворителя в реакциях мономолекулярного замещения.
Переходное состояние SNl-процесса более полярно, чем исходные реагенты. Это приводит к тому, что при увеличении диэлектрической проницаемости растворителя сольватация переходного состояния увеличивается сильнее, чем сольватация исходного состояния. Следовательно, при увеличении полярности среды энергии переходного и исходного состояний будут снижаться, причем для переходного состояния это снижение будет большим. Это должно приводить к росту скорости диссоциации с ростом полярности растворителя. Так, для третбутилиодида (250C):
| Растворитель | C6H6 | C6H5OCH3 | C6H5CF3 | C6H5NO2 | C6H5CN |
| ξ | 2,28 | 4,33 | 9,18 | 35 | 25,2 |
| k * 106, с-1 | 0,275 | 0,424 | 0,800 | 3,00 | 3,69 |
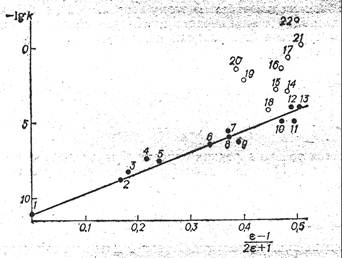
Так как активированный комплекс можно рассматривать как диполь, следовало ожидать, что между lg k и функцией Кирквуда (ξ - 1) / (2ξ + 1) будет наблюдаться линейная зависимость. Из из рис. Х-l видно, что такая корреляция действительно наблюдается для апротонных растворителей. В то же время протонные растворители ускоряют реакцию сольволиза трет-бутилхлорида значительно сильнее, чем можно было
|
|
Рис. X-I. Зависимость lgk сольволиза (CH3)3CCl при 1200С от (ξ-1)(2ξ+1) в протонных (О) и апротонных (О) растворителях: 1 – газовая фаза; 2 – гептан; 3 – циклогексан; 4 – бензол; 5 – триэтиламин; 6 – анизол; 7 – пиперидин; 8 – хлорбензол; 9 – этилацетат; 10 – ацетон; 11- нитробензол; 12 – ацетонитрил; 13 – диметилформамид; 14 – изопропиловый спирт; 15 – бутиловый спирт; 16 – этиловый спирт; 17 – метиловый спирт; 18 – трет-бутиловый спирт; 19 – анилин; 20 – уксусная каслота; 21 – формамид; 22 – вода. |