Реакции нуклеофильного замещения
В то же время многие реакции нуклеофильного замещения идут с полной потерей оптической активности при каждом акте реакции. Так, реакция сольволиза оптически активного α-хлорэтилбензола в 80%-ном водном растворе ацетона сопровождается 97%-ной рацемизацией: D-С6Н5СНСlСН3 → DL-С6Н5СНОНСН3
Кинетический характер реакций нуклеофильного замещения.
Наиболее часто реакции нуклеофильного замещения описываются одним из двух кинетических уравнений.
Реакция может описываться уравнением первого порядка. В этом случае скорость процесса не зависит ни от концентрации, ни от природы нуклеофила: υ = k [RX]
Такое кинетическое уравнение свидетельствует о том, что нуклеофил не принимает участия в скоростьопределяющей стадии процесса и предшествующих ей предравновесных стадиях. В то же время изменение соотношения образующихся продуктов при использовании смесей нуклеофилов и при варьировании их концентраций является доказательством того, что нуклеофил участвует в реакции на быстрой стадии, следующей за скорость определяющей.
Во втором случае реакция имеет суммарный второй порядок и первый порядок как по субстрату, так и по нуклеофилу: υ = k [RX] [Y-]
Для таких реакций характерна высокая зависимость скорости процесса от природы нуклеофила. Так, для реакции C4H9Br + Y- в этиловом спирте при 250С, при переходе от Y- = С6Н5О- к Y- = C6H5S- скорость возрастает в 1300 раз.
Следует иметь в виду, что первый порядок реакции еще не свидетельствует об обязательной мономолекулярности процесса. Так, в реакциях сольволиза, когда в качестве реагента выступает растворитель, бимолекулярная реакция может описываться уравнением первого порядка (псевдомономолекулярный процесс): υ = k [RX][SOH]
Так как [SOH] = const, υ = k' [RX].
Таким образом, реакции нуклеофильного замещения могут различаться как по кинетическому описанию, так и по стереохимическим результатам. При этом в большинстве случаев реакции, сопровождающиеся обращением конфигурации, описываются кинетическими уравнениями второго порядка, в то время как, реакции, идущие с рацемизацией, подчиняются кинетическим уравнениям первого порядка. Можно с большой вероятностью предположить, что кинетические и стереохимические критерии изменяются в результате смены механизма реакции.
Из изложенного видно, что реакции нуклеофильного замещения действительно могут происходить, как минимум, по двум различным механизмам.
КИНЕТИКА РЕАКЦИЙ МОНОМОЛЕКУЛЯРНОГО ЗАМЕЩЕНИЯ.
При диссоциации органической молекулы R-X, происходящей под влиянием растворителя, вначале образуются ионные пары, а затем - свободные ионы. Рассмотрим простейший случай, когда продукт замещения получается на стадии взаимодействия свободного карбкатиона с нуклеофилом. Тогда процесс замещения может быть описан следующей схемой:
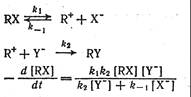
(X-1)
Рассмотрим факторы, влияющие на суммарную скорость процесса, т. е. на скорость стадии диссоциации.
На ранних стадиях реакции концентрация Х- очень мала, и обычно k2 [Y] >>k-1 [Х-].
В этом случае скорость реакции может быть описана следующим уравнением:
-d[RX] / dt = k1 [RX] в присутствии сильных нуклеофилов k2 > k-l и скорость реакции подчиняется тому же уравнению. Таким образом, скорость определяющей стадией является диссоциация на ионы, и для SN1-процесса природа и концентрация нуклеофила не сказываются на скорости процесса.
Исключение составляет случай, когда добавляемый нуклеофил и уходящая группа идентичны. Как видно из уравнения (Х-l), увеличение концентрации Х- должно приводить к уменьшению скорости процесса (эффект общего иона). Ниже представлены данные Ингольда по влиянию добавок солей (0,1 моль/л) на скорость сольволиза бензгидрилгалогенидов в 80%-ном ацетоне при 250С:
| Без соли | LiBr | LiCl | |
|
Х = Сl | |||
|
k * l05, с-1 | 7,00 | 8,16 | 6,09 |
|
изменение скорости, % | - | +17 | -13 |
|
Х = Вr | |||
|
k * 103, c-1 | 1,53 | 1,33 | 1,94 |
|
изменение скорости, % | - | -13 | +27 |
Таким образом, добавление одноименного иона приводит к замедлению процесса (эффект общего иона). Некоторое увеличение скорости при добавлении соли, не содержащей одноименного иона, объясняется увеличением ионной силы раствора и называется первичным солевым эффектом.
Наличие эффекта общего иона является одним из основных признаков течения реакции по SN1-механизму с образованием свободных карбкатиона и аниона Х-. Эффектом общего иона объясняется и возможное падение константы скорости при увеличении конверсии субстрата: (H3C─ C6H4)2CHCl → (H3C─C6H4)2CHOH
|
Конверсия, % | 8,0 | 16,2 | 27,6 | 37,5 | 48,9 | 57,0 | 69,2 |
|
k * 10-5, с-1 | 8,68 | 8,30 | 7,83 | 7,53 | 7,33 | 7,05 | 6,87 |
По мере гидролиза в растворе увеличивается концентрация хлорид-ионов, что и приводит к падению суммарной константы скорости реакции, в соответствии с уравнением (Х-l). В тех случаях, когда скорость определяющей стадией процесса является гетеролитический разрыв связи С─Х, активированный комплекс имеет следующий вид
Rδ+…Xδ-
Связь С─Х в активированном комплексе частично разорвана, а на углеводородной части субстрата и уходящей группе локализованы дробные заряды противоположного знака. Ионный разрыв связи С─Х требует значительной затраты энергии. Так, в газовой фазе энергии ионной диссоциации RBr по связи С-Вr имеют следующие значения:
|
R | CH3 | CH2=CH-CH2 | C6H5CH2 |
|
Eдион, кДж/моль | 895 | 635 | 614 |
