Реакции нуклеофильного замещения
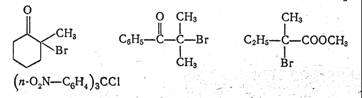
Увеличение стерических затруднений при переходе от первичных систем к вторичным и третичным приводит к тому, что, как правило, реакции бимолекулярного нуклеофильного замещения при третичном атоме углерода практически не идут. Только в некоторых специфических случаях, когда используется весьма реакционно-способный нуклеофил, а образование карбкатиона (и, следовательно, SNl-реакция) затруднено за счет наличия в молекуле сильных электроноакцепторных заместителей вне посредственной близости к реакционному центру, SN2-реакция может осуществляться даже в третичных системах. Так, по SN2-механизму идут реакции замещения галогена на азид-ион в следующих соединениях:
Электронные эффекты заместителей в субстрате.
В случае реакций мономолекулярного замещения сделать вывод о влиянии заместителей на скорость процесса достаточно легко. В случае SN2-реакций картина более сложна. Как и ранее необходимо рассмотреть, как меняется электронная плотность на реакционном центре при переходе от исходных соединений к активированному комплексу. Возможно такое течение SN2-процесса, при котором на реакционном центре не происходит изменения заряда. Для этого необходимо, чтобы реакция замещения шла строго согласованно, т. е. в переходном состоянии связь с нуклеофилом должна образовываться точно в той же степени, в которой нарушается связь с уходящей группой. (Другими словами, сумма порядков связей с нуклеофилом и уходящей группой в переходном состоянии должна равняться единице). При этом можно ожидать, что электронные эффекты заместителей не будут существенно сказываться на скорости процесса. (Более строго, и в этом случае для реакций анион─молекула заместители, проявляющие электроноакцепторное влияние, должны несколько ускорять процесс замещения за счет стабилизации отрицательно заряженного активированного комплекса.) Однако, хотя реакция бимолекулярного замещения и является синхронной, т. е. процессы разрыва старой связи и образования новой происходят на одной и той же стадии реакции, они не являются строго согласованными. Разрыв старой связи может обгонять образование новой (случай А, сумма порядков связей меньше единицы, электронная плотность на реакционном центре ниже в активированном комплексе, чем в исходной молекуле). Такое переходное состояние может быть названо «рыхлым» (loose). В других случаях разрыв старой связи может отставать от образования новой (случай Б, сумма порядков связей больше единицы, электронная плотность на реакционном центре больше в активированном комплексе, чем в исходной молекуле). Такое анионоподобное переходное состояние называют «сжатым» (tight). Только в некоторых случаях разрыв старой и образование новой связи осуществляются строго согласованно («центральное» переходное состояние В).
Влияние электронных эффектов заместителей на скорость реакции будет зависеть от вида переходного состояния. Для реакций с переходным состоянием типа А положительный заряд увеличивается при переходе от исходной молекулы к активированному комплексу, и можно ожидать ускоряющего действия электронодонорных заместителей, а для реакций с переходным состоянием типа Б происходит уменьшение положительного заряда, и реакция должна ускоряться электроноакцепторными заместителями.
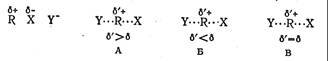
Эксперимент показывает, что для большинства реакций бимолекулярного замещения характерно ускорение электроноакцепторными заместителями и, таким образом, образование новой связи обгоняет разрыв старой.
При обсуждении факторов, влияющих на строение активированного комплекса в SN2-реакциях, следует иметь в виду, что рассмотренные ранее принцип Белла - Эванса - Полян и постулат Хэммонда не применимы в простой форме к процессам, в которых порядки рвущейся и образующейся связей не изменяются строго согласованно. Для таких реакций требуются более сложные модели для суждения о влиянии варьирования строения реагентов и условий проведения реакции на положение переходного состояния на координате реакции. Для SN2-реакций плодотворным оказалось использование уже рассмотренных понятий «сжатости» и «рыхлости» переходного состояния. Если строение субстрата таково, что возможна значительная стабилизация катионоидного (рыхлого) переходного состояния, то разрыв старой связи обгоняет образование новой, и реакция ускоряется при введении электронодонорных заместителей. Если возможна стабилизация сжатого анионоподобного переходного состояния, образование новой связи обгоняет разрыв старой, и реакция ускоряется при введении электроноакцепторных заместителей в субстрат.
При изучении зависимости скорости SN2-обмена галогена были получены следующие результаты:
|
ArSCH2Cl + Cl- |
ρ = -0,92 |
|
ArCH2CH2Cl + Cl- |
ρ = +0,57 |
|
ArCH2Cl + Cl- |
U-образная зависимость |
В первой из рассматриваемых реакционных серий наличие атома серы в α-положении к реакционному центру способствует стабилизации положительного заряда, сумма порядков связей в симметричном переходном состоянии меньше единицы, и переходное состояние является рыхлым (ρ < 0). Естественно, что порядки связей с уходящим атомом галогена и с атомом галогена, выступающим в роли нуклеофила, равны вследствие симметрии системы. Во второй реакционной серии переходное состояние является сжатым и реакция ускоряется электроноакцепторными заместителями (ρ > 0). В случае бензилгалогенидов рыхлость - сжатость переходного состояния меняется в пределах одной реакционной серии, и поэтому реакция ускоряется как электроноакцепторными, так и электронодонорными заместителями.
Природа уходящей группы.
Изменение уходящей группы качественно должно сказываться на скорости реакций SN2-замещения так же, как и на скорости SN1-реакций. Ускорению процесса будут способствовать все факторы, уменьшающие энергию диссоциации по связи С─Х и стабилизирующие образующийся анион. Если при этом разрывается одна и та же связь (например, связь С─О), реакционная способность соединения будет тем выше, чем более сильной является кислота, сопряженная аниону Х-). В связи с этим электроноакцепторные заместители в уходящей группе ускоряют реакцию, так как они стабилизируют частичный отрицательный заряд, возникающий в переходном состоянии:
СН3ОSО2-С6Н4-Х-n + Н2О → СН3ОН
| X | NO2 | Br | H | CH3 | CH3O |
| kотн (500С) | 5,9 | 1,7 | 1 | 0,69 | 0,5 ρ = 0,9 |
