Реакции нуклеофильного замещения
бы предполагать, исходя из значений ξ для этих растворителей. Это связано с тем, что наряду с неспецифической сольватацией большую, а во многих случаях и определяющую роль играет специфическая сольватация и, в первую очередь, стабилизация уходящей группы за счет образования водородных связей с растворителем. (Как показано в последние годы специфическая сольватация образующегося третичного карбкатиона практически не имеет места.). Роль специфической сольватации уходящей группы тем выше, чем большими кислотными свойствами обладают молекулы растворителя.
Для учета влияния специфической сольватации растворителя предложены различные методы. Наибольшее распространение для характеристики способности растворителя изменять скорость SN1-реакций получило уравнение Грюнвальда - Уинстейна: lg k/ko = mY, где Y - мера ионизирующей способности растворителя и зависит только от свойств среды (по определению Y = О для 80 %-ного водного раствора этилового спирта); m характеризует степень чувствительности изучаемой реакции к смене ионизирующей силы растворителя и зависит от строения субстрата и условий проведения реакции; для стандартной реакции m = 1. Таким образом, при увеличении значения Y для растворителя скорость SNl-процесса увеличивается. Следует отметить, что прямая зависимость между диэлектрической проницаемостью растворителя и его ионизирующей силой существует не всегда.
Чувствительность к смене ионизирующей силы растворителя зависит от изменения полярности системы при переходе от исходного состояния к активированному комплексу и может быть использована в качестве характеристики полярности переходного состояния. Чем в большей степени увеличивается разделение зарядов в переходном состоянии, тем больше, в общем случае, значение m.
При введении электронодонорных заместителей в ароматическое ядро стабилизируется образующийся катион. Это снижает эндотермичность реакции и, в соответствии с постулатом Хэммонда, уменьшает степень разделения зарядов в переходном состоянии, что и приводит к уменьшению значения m.
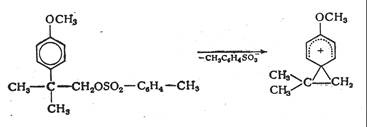 Уравнение Грюнвальда - Уинстейна не является универсальным и достаточно хорошо описывает только реакции третичных систем, идущие по чистому диссоциативному механизму (т. е. SN1 - Еl). В случае вторичных систем необходимо учитывать возможность нуклеофильной сольватации образующегося катиона, которая практически отсутствует в стандартной серии. Кроме того, недостаточная универсальность этого уравнения связана также с тем, что при варьировании структуры растворителя в широких пределах возможно и частичное изменение направления процесса сольволиза трет-бутилхлорида - наряду с чистым SN1-процессом реакция замещения может идти за счет взаимодействия ионной пары с нуклеофилом. Для достаточно основных растворителей становится заметной и реакция бимолекулярного отщепления, где в роли основания выступает молекула растворителя. В связи с этим для характеристики ионизирующей силы растворителя были предложены и другие реакционные серии. Уинстейн с сотрудниками предложили в качестве стандартной реакции использовать сольволиз n-метоксинеофил-n-толуолсульфоната:
Уравнение Грюнвальда - Уинстейна не является универсальным и достаточно хорошо описывает только реакции третичных систем, идущие по чистому диссоциативному механизму (т. е. SN1 - Еl). В случае вторичных систем необходимо учитывать возможность нуклеофильной сольватации образующегося катиона, которая практически отсутствует в стандартной серии. Кроме того, недостаточная универсальность этого уравнения связана также с тем, что при варьировании структуры растворителя в широких пределах возможно и частичное изменение направления процесса сольволиза трет-бутилхлорида - наряду с чистым SN1-процессом реакция замещения может идти за счет взаимодействия ионной пары с нуклеофилом. Для достаточно основных растворителей становится заметной и реакция бимолекулярного отщепления, где в роли основания выступает молекула растворителя. В связи с этим для характеристики ионизирующей силы растворителя были предложены и другие реакционные серии. Уинстейн с сотрудниками предложили в качестве стандартной реакции использовать сольволиз n-метоксинеофил-n-толуолсульфоната:
Реакция идет с анхимерным содействием, и диссоциативный механизм без нуклеофильной сольватации сохраняется в малополярных нуклеофильных растворителях.
 Шлейер с сотрудниками предложили в качестве модельной реакции сольволиз l-бромадамантана:
Шлейер с сотрудниками предложили в качестве модельной реакции сольволиз l-бромадамантана:
В этом случае отсутствуют побочные реакции отщепления, возможные в растворителях высокой нуклеофильности, и характеризуется только способность растворителя облегчать ионизацию галогенида.
СООТНОШЕНИЕ СКОРОСТЕЙ МОНОМОЛЕКУЛЯРНОГО ЗАМЕЩЕНИЯ И ОТЩЕПЛЕНИЯ.
Если в карбкатионе в α-положении к катионному центру имеется С─Н-связь, то наряду с реакцией замещения возможен отрыв протона нуклеофилом с образованием продукта отщепления. Поэтому реакции отщепления всегда конкурируют с реакциями замещения:
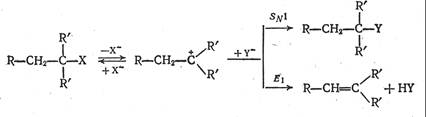
Механизм отщепления, приведенный на данной схеме, обозначается как Еl (elimination - отщепление). Так как скорость определяющей стадией, как и в случае SNl-реакции, является диссоциация субстрата по связи С─Х, влияние всех факторов на скорость процесса Еl то же, что и для реакций мономолекулярного замещения. Образовавшийся на скоростьопределяющей стадии карбкатион может взаимодействовать с нуклеофилом либо за счет отрыва протона (тогда образуются продукты отщепления), либо за счет уже рассмотренного процесса с образованием продукта замещения. Таким образом, соотношение продуктов, соответствующих замещению и отщеплению, а также соотношение образующихся олефинов зависит от отношения скоростей быстрых стадий взаимодействия нуклеофила с карбкатионом.
Переходное состояние для стадии отрыва протона, приводящее к олефину, можно представить следующим образом:
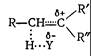
Поскольку оно обладает некоторой двоесвязностью, то факторы, стабилизирующие олефин, должны понижать энергию соответствующего переходного состояния и, следовательно, увеличивать скорость процесса. Из термохимических данных следует, что для изомерных олефинов стабильность тем выше, чем больше алкильных заместителей находится при двойной связи. Отсюда можно сделать вывод, что в реакциях Еl преимущественно должен образовываться наиболее замещенный олефин, т.е. реакция идет в соответствии с правилом Зайцева:
СН3СН2-СВr(СНЗ)2 → СН3-СН=С(СН3)2 + С2Н5-С(СН3)=СН2
79% 21%
Реакции бимолекулярного отщепления обычно осуществляются как анти-процесс. Для реакций мономолекулярного отщепления такой зависимости строения продуктов от стереохимического строения исходного соединения не наблюдается, так как отщепление уходящей группы с образованием плоского карбкатиона происходит на стадии, предшествующей отщеплению протона. Что же касается стереохимии образующегося олефина, то обычно в большем количестве образуется более термодинамически стабильный изомер.
При увеличении стерических внутримолекулярных взаимодействий в субстрате скорость мономолекулярного процесса увеличивается за счет снятия стерических напряжений в возникающем sр2-гибридизованном карбкатионе. При присоединении нуклеофила к карбкатиону с образованием продукта замещения происходит обратное изменение гибридизации атома углерода - от sp2 к sp3, что повышает энергию переходного состояния этой стадии. В то же время при Еl реакции атом углерода остается в состоянии sр2-гибридизации также и в конечном олефине и увеличения стерических напряжений не происходит. Следовательно, по мере увеличения стерических затруднений в субстрате реакция отщепления становится более выгодной по сравнению с реакцией замещения. Естественно, что природа уходящей группы не должна сказываться на соотношении продуктов замещения и отщепления. Значительное влияние на относительные скорости отщепления и замещения оказывает природа нуклеофила. Чем более основным является нуклеофил, тем в большей степени увеличивается вероятность отрыва протона с образованием продуктов отщепления. Из рассмотрения переходных состояний быстрых стадий SNl- и Еl-процессов
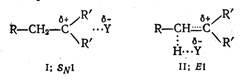 |
