Реакции нуклеофильного замещения
Большая роль стабилизации образующегося аниона приводит к тому, что и в SN2-реакциях трифлаты оказываются очень реакционноспособными соединениями: k(С2Н5ОSО2СF3)/k(С2Н5ОSО2С6Н4СНЗ)= 30000 (для ацетолиза при 250С).
Как и ранее, большую роль играет энергия разрывающейся связи С─Х. Реакционная способность галогенидов изменяется в порядке: F << Сl < Br < I
В качестве примера можно привести реакции обмена галогена в метилгалогенидах (ацетон, 250С): СН3Х + Сl- → СН3Сl + Х-
| Х | Cl | Br | I |
| k * 103, л/(моль*с) | 1,4 | 59,5 | 4700 |
В переходном состоянии реакции SN2 у центрального атома углерода находятся пять заместителей. В связи с этим увеличение стерического объема уходящей группы в большей степени дестабилизирует переходное состояние, чем исходное, и скорость реакции должна уменьшаться. По-видимому, по этой причине тозилаты менее реакционноспособны в реакциях SN2, чем бромиды. Следует, однако, отметить, что влияние изменения стерического объема уходящей группы сильно зависит от природы реакции и в некоторых реакциях проявляется довольно слабо. Очень сильно на реакционной способности сказывается изменение сольватации уходящей группы.
Таким образом, при рассмотрении влияния уходящей группы на скорость замещения в целом наблюдается аналогия между реакциями SNl и SN2. Различие между этими типами реакций в основном связано с тем, что в случае бимолеку.лярного замещения связь С─Х в переходном состоянии растянута значительно меньше, чем в мономолекулярных реакциях (например, показано, что кинетический изотопный эффект хлора значительно меньше в бимолекулярных, чем в мономолекулярных реакциях одних и тех же субстратов). Поэтому чувствительность к смене уходящей группы в реакциях SN2 существенно меньше.
Для количественного учета влияния смены уходящей группы на скорость замещения предложено несколько корреляционных уравнений, которые, однако имеют ограниченное применение.
ВЛИЯНИЕ РАСТВОРИТЕЛЯ НА СКОРОСТЬ SN2-РЕАКЦИИ.
Начиная с работ Н. А. Меншуткина, влияние растворителя на скорость реакций бимолекулярного нуклеофильного замещения изучается очень многими исследователями. Первоначально рассматривалось только влияние неспецифической сольватации. Ингольдом и Хьюзом была построена модель, позволяющая учитывать влияние изменения диэлектрической проницаемости растворителя на скорость реакций замещения. При этом главное внимание обращалось на электростатическое взаимодействие растворителя с исходными соединениями и активированным комплексом.
Для того чтобы предсказать, как изменится скорость процесса при варьировании диэлектрической проницаемости среды, необходимо рассмотреть распределение зарядов в исходном и переходном состояниях. Основным предположением теории Хьюза-Ингольда является то, что полярный растворитель лучше сольватирует состояние, в котором заряд более локализован. В зависимости от того, являются нуклеофил и уходящая группа нейтральными или заряженными, можно разбить реакции бимолекулярного замещения на четыре типа, причем увеличение диэлектрической проницаемости среды (полярности) будет сказываться на скорости реакций бимолекулярного замещения следующим образом:
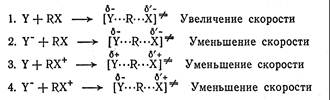
В первом случае, при взаимодействии незаряженного нуклеофила с незаряженным субстратом, происходит разделение разноименных зарядов. Таким образом, переходное состояние является более полярным, чем исходное, и увеличение полярности растворителя приводит к большей сольватации переходного состояния и, следовательно, к росту скорости процесса: (С2Н5)3N + C2H5I → (C2H5)4N+ + I-
| Растворитель | C6H6 | C6H5F | C6H5Cl | C6H5CN | C6H5 NO2 | (CH3)2 SO |
| ξ | 2,2 | 5,4 | 5,6 | 25 | 35 | 49 |
| k * 105, л/(моль*с) (1000С) | 40,8 | 91 | 138 | 1120 | 1380 | 12000 |
Во втором случае в переходном состоянии по сравнению с исходным делокализуется отрицательный заряд, а в третьем случае - положительный. Это приводит к тому, что полярный растворитель лучше сольватирует исходное состояние, чем переходное, и скорость реакции снижается: I*- + CH3I → δ-[I*…CH3…I]δ-≠ → I- + CH3I*
| Растворитель | CH3COOH | C2H5OH | CH3OH | (CH2OH)2 | H2O |
| kотн | 26900 | 65 | 22 | 21 | 1 |
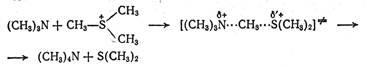
| Растворитель | CH3NO2 | C2H5OH | CH3OH | H2O |
| kотн | 119 | 10 | 6 | 1 |
Наконец, в четвертом случае происходит нейтрализация разноименных зарядов, что также при водит к уменьшению скорости реакции при росте полярности растворителя:
![]()
|
Содержание воды в водно-спиртовом растворителе, % | 0 | 20 | 40 | 100 |
|
kотн | 20000 | 480 | 40 | 1 |
