Общая и неорганическая химия
Осмос также играет большую роль в экологии водоёмов. Если концентрация соли и других веществ в воде поднимется или упадёт, то обитатели этих вод погибнут из-за пагубного воздействия осмоса.
Вант-Гоффа закон
Вант-Гоффа закон осмотического давления, определяет давление молекул растворённого вещества на полупроницаемую перепонку, отделяющую раствор от чистого растворителя и непроницаемую для растворённого вещества
Давление насыщенного пара является важным свойством раствора.
Если к чистому растворителю с давлением насыщенного пара р0 добавить постороннее нелетучее вещество, то давление пара растворителя над раствором изменится. При растворении какого-либо нелетучего вещества в данном растворителе понижается концентрация молекул последнего в единице объема жидкости, и уменьшается число молекул, вылетающих в единицу времени из жидкой фазы в парообразную. При меньшей концентрации пара, т.е. при меньшем его давлении, установится равновесие.
Следовательно, давление насыщенного пара растворителя над раствором всегда меньше, чем над чистым растворителем. Понижение давления насыщенного пара растворителя над раствором тем больше, чем выше концентрация растворенного вещества. Для идеальных растворов давление насыщенного пара определяется законом Рауля, установленного им в 1886 г.: относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного вещества, т.е. отношению количества данного вещества к общему количеству растворителя и растворенного вещества:
Др / р0 = р0 - р/р0 = n2 / n1 + n2 = х2, где
р0 - давление пара растворителя над чистым растворителем,
р - давление пара растворителя над раствором,
Др / р0 - относительное понижение давления пара растворителя,
n2 - количество растворенного вещества,
n1 - количество вещества растворителя,
х2 - молярная доля растворенного вещества.
Это уравнение можно представить в другом виде и придать закону иную формулировку:
![]()
давление пара над раствором равно произведению давления пара над чистым растворителем на молярную долю растворителя.
Для очень разбавленных растворов уравнение имеет вид:
![]()
m1 и m2 - массы растворителя и растворенного вещества соответственно,
М1 и М2 - молярные массы растворителя и растворенного вещества соответственно.
2) Понижение давления насыщенного пара влечет за собой понижение температуры замерзания раствора по сравнению с чистым растворителем.
Жидкость замерзает при той температуре, при которой давление насыщенного пара над ней такое же, как и над кристаллами этого вещества. Так как давление насыщенного пара растворителя над раствором всегда меньше, чем над чистым растворителем, то разбавленный раствор будет замерзать при более низкой температуре, чем растворитель. Температурой замерзания раствора считают ту температуру, при которой в процессе охлаждения начинают выделяться первые кристаллы чистого растворителя. Для таких растворов Рауль нашел, что понижение температуры замерзания раствора Дtз. = t0 - t (t0 - температура замерзания растворителя, t - температура замерзания раствора) пропорционально его моляльности (1 моль в 1000 г растворителя):
Дtз = К · m, где
Дt - понижение температуры замерзания,
m - моляльность раствора,
К - криоскопическая постоянная ("криос" - холод).
Физический смысл криоскопической постоянной К состоит в том, что она равна понижению tз. раствора, содержащего 1 моль растворенного вещества на 1 кг растворителя. Величина К зависит от природы растворенного вещества, если его молекулы не диссоциируют и не ассоциируют.
Величину К можно рассчитать по формуле
![]()
T0 -температура замерзания растворителя,
l пл - удельная теплота плавления растворителя.
Так как
![]() [моль/кг], то
[моль/кг], то ![]()
m1 - масса растворителя,
m2 - масса растворенного вещества.
3) Повышение температуры кипения.
Жидкость закипает при температуре, при которой давление насыщенного пара жидкости становится равным внешнему давлению. Так как давление насыщенного пара растворов нелетучих или малолетучих веществ меньше давления насыщенного пара растворителя, то эти растворы кипят при более высокой температуре, чем растворитель. Для разбавленных растворов таких веществ Рауль установил, что повышение температуры кипения раствора Дtк. = t - t0 пропорционально его моляльности:
Дtк. = Е · m, где
Е - эбуллиоскопическая постоянная ("эбуллиос" - кипеть),
m - моляльность раствора.
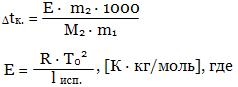
T0 -температура кипения растворителя,
lисп. - удельная теплота испарения растворителя. Величина Е численно равна повышению tк моляльного раствора при условии сохранения свойств раствора до этой концентрации. Метод определения молярной массы на основе измерения понижения температуры замерзания Дtз растворов - метод криоскопии, на основе измерения повышения температуры кипения Дtк. - эбуллиоскопический метод. Более распространен первый метод, так как Дtк растворов обычно мала и на нее влияют такие факторы как изменение внешнего давления, перегрев раствора и т.д. Одним из важных свойств растворов является осмос. Если отделить раствор от растворителя мембраной, проницаемой лишь для частиц растворителя, то будет наблюдаться самопроизвольный переход растворителя в раствор. Явление самопроизвольной диффузии растворителя через полупроницаемую перегородку в раствор называется осмосом. Сила, рассчитанная на единицу площади мембраны, заставляющая переходить растворитель через полупроницаемую перегородку в раствор, называется осмотическим давлением. По определению Вант-Гоффа осмотическое давление разбавленных растворов численно равно произведению молярной концентрации и температуры:
р = с · R · T,
где с - молярная концентрация.
Так как с = n / v, где n - количество вещества (моль), v - объем раствора (л), то
р = n / v · R · T,
Зависимость осмотического давления от понижения давления пара растворителя над раствором выражается уравнением:
![]()
где М0 - молярная масса растворителя. Уравнение Вант-Гоффа распространяется только на разбавленные растворы. При изучении свойств растворов электролитов (кислоты, щелочи, соли) было обнаружено, что этим растворам присущи все основные свойства растворов неэлектролитов, такие, как понижение давления насыщенного пара над раствором, понижение температуры замерзания, повышение температуры кипения и осмотическое давление. Однако эти величины для растворов электролитов оказались иными, чем следовало ожидать, исходя из их молярных концентраций.
Вант-Гофф, чтобы применить законы растворов неэлектролитов к электролитам, ввел поправочный множитель, названный изотоническим коэффициентом i. Этот коэффициент показывал, во сколько раз наблюдаемое осмотическое давление (рtз., рtк.) больше вычисленного, т.е.
