Общая и неорганическая химия
Если э. д. с. вспомогательной батареи ВБ равна ЕБ, то э. д. с. элемента X ЕX определяется из пропорции:
ЕХ/ЕБ = АС/АВ, откуда ЕX = (АС/АВ) ЕБ.
Для того, чтобы откалибровать вспомогательную батарею перед измерениями ЕX, вместо элемента X включают другой, э. д. с. которого точно известна, например стандартный элемент Вестона. Устройство этого элемента будет описано ниже.
Повторим, что определяемая таким образом э. д. с. максимальна, так как при измерении отсутствует падение потенциала как вне, так и внутри элемента. Работа, совершаемая элементом с ничтожно малым током при обратимом проведении процесса была бы максимальной.
Теоретический и практический интерес представляют гальванические элементы с металлическими электродами. Рассмотрим, например, реакцию Znт + CuSО4водн. р-р. = ZnSО4водн. р-р + Cuт или Znт + Cu2+ = Zn+2 + +Cuт, которая может быть осуществлена двумя путями. Один из них является полностью необратимым. Цинковую пластинку помещают в водный раствор медного купороса, при этом происходит выделение металлической меди и растворение цинка. Электроны переходят от цинка непосредственно к меди, и реакция протекает без производства работы, а сопровождается только выделением тепла. В случае водородно-кислородного элемента, можно создать условия, в которых электроны будут двигаться по металлическому проводнику и совершать работу. Это достигается в гальваническом элементе, где цинковый электрод погружен в раствор ZnSO4, а медный электрод в раствор СиSO4.
Растворы отделены друг от друга пористой (керамической) перегородкой, препятствующей их смешению, но обеспечивающей прохождение электрического тока вследствие диффузии ионов через поры. Такой элемент, на электродах которого образуются двойные электрические слои, был сконструирован русским электрохимиком Б.С. Якоби.
Величина и знак электрических зарядов в двойных слоях пределяются работой удаления электрона из металла и энергией гидратации его ионов. В раствор легко будут переходить те металлы, у которых меньше работа выхода электронов и больше энергия гидратации ионов, т.е. менее благородные металлы. Так как цинк менее благороден, чем медь, то он зарядится более отрицательно по сравнению с медью. Если соединить оба электрода металлическим проводником, то электроны будут перемещаться от цинка к меди. Вследствие этого ионы цинка Zn2+ не удерживаются в двойном слое притяжением электронов, переходят в объем раствора, а перешедшие на медный электрод электроны разряжают ионы Cu2+, переводя их в металлическое состояние.
Следовательно, в процессе работы элемента происходит растворение цинкового электрода и осаждение меди на медном электроде. Чтобы элемент работал, цепь должна быть замкнутой, т.е. между растворами должен быть электрический контакт. Перенос тока внутри элемента осуществляется ионами. В элементе переход электронов от цинка к меди происходит не в условиях непосредственного контакта этих металлов, а при помощи проводника. Суммарная реакция в элементе складывается из двух пространственно разделенных электродных процессов.
Реакции, протекающие в гальванических элементах являются окислительно-восстановительными. В рассматриваемом случае окисляется цинк, который теряет электроны, а восстанавливается медь, приобретающая электроны. Вообще любая окислительно-восстановительная реакция может быть использована для получения электрического тока с помощью гальванического элемента. Как упоминалось, такой реакцией может быть горение любого вида топлива.
При схематической записи гальванических элементов границы между фазами отмечаются вертикальными линиями. При условии, что на границе двух жидкостей (в данном случае растворов ZnSO4 и CuSO4) нет разности потенциалов, ее обозначают двумя вертикальными линиями. Схема рассмотренного элемента имеет следующий вид:
Zn ∣ ZnSO4 ∥ CuSO4 ∣ Cu.
Принято записывать подобные схемы таким образом, чтобы левый электрод был отрицательным (электроны текут по металлическому проводнику слева направо и в том же направлении переносится ионами положительное электричество внутри элемента). Такая запись отвечает протеканию реакции, сопровождающейся убылью энергии Гиббса и положительной величине э. д. с.
Гальванические элементы могут быть построены не только с использованием водных растворов электролитов, но и с, применением расплавов. Примером такого элемента может служить цепь Ag ∣ AgBr ∣ Br2, в которой левый электрод серебряный, а правый - представляет собой графит, омываемый газообразным бромом, а электролитом является расплавленное AgBr. На левом электроде растворяется серебро: Agт → Ag+ + e, а на правом - адсорбированный графитом бром: 1/2Br2г + e = Br-. Таким образом, в элементе происходит реакция: Agт + 1/2Br2г = AgBrж.
В последнее время приобрели большое значение гальванические элементы с твердыми электролитами, имеющими кислородную проводимость (см. гл. VIII), например,
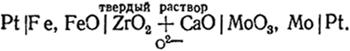
Левый электрод представляет собой смесь железа и его оксида. Здесь происходит реакция окисления железа ионами О2-, приходящими через твердый электролит. При этом освобождаются электроны, и электрод получает отрицательный заряд. На правом электроде, состоящем из смеси Мо и МоО3, происходит восстановление оксида. Это сопровождается поглощением электронов таким образом, что электрод заряжается положительно, а освободившиеся ионы О2 могут мигрировать через электролит к левому электроду. Реакция на электроде изображается следующим уравнением 3Feт + 3О2- = 3FеОт + 6е; на правом электроде: МоО3т + 6е = Мот + 3О2-.
Заметим, что сумма этих двух реакций 3Fет + МоОт = 3FеОт + Мот есть процесс восстановления оксида молибдена железом, самопроизвольное протекание которого является источником электрической энергии производимой элементом.
Из рассмотренных примеров видно, что реакцию, протекающую в гальваническом элементе, можно представить в виде двух отдельных электродных реакций.
Можно предположить, что э. д. с. гальванического элемента должна зависеть от природы реагирующих веществ, их концентраций и температуры. Чтобы найти выражения для этих зависимостей, необходимо рассмотреть термодинамические соотношения, характеризующие работу гальванического элемента.
Пусть в гальваническом элементе протекает реакция: M + Nn+ = Mn+. Работа, производимая элементом при расходе 1 моля М, определяется произведением количества электричества nF на величину э. д. с. Е, т.е. W = nFE, где п - число молей электронов, протекающих через цепь; F - число Фарадея, равное 96493 Кл. Например, для реакции Zn + Cu2+ = Zn2+ + Cu, n = 2. Если элемент работает обратимо при постоянных давлении и температуре, то произведенная им работа равна убыли энергии Гиббса, т.е. ДG = W:
ДG = -nFE = -96493E. (IX.1)
Если элемент работает необратимо, то nFE < -ДG, т.е. э.д.с. меньше, чем при обратимом проведении реакции. Выражая E в В, получаем величину ДG в Дж.
Таким образом, если известно стехиометрическое уравнение протекающей в гальваническом элементе реакции и табличные данные об изменении энергии Гиббса, можно рассчитать э. д. с.
