Общая и неорганическая химия
(1) 2MnO4- + 16H+ +10 I- = 4Mn2+ + 8H2O + 5 I2Ї; n=10;
(2) 2MnO4- + 8H+ + 6I- = 2MnO2 + 4H2O + 3I2Ї; n=6;
(3) 2MnO4- + 2I- = 2MnO42- + I2Ї; n=2;
Выразим эдс этих трех систем через рН, принимая все прочие концентрации стандартными.
e1 = 1,51 - 0,54 + 0,00591lg[H+]16 = 0,97 - 0,0946pH (B); DG = -nFe; D1G/F = -9,7 + 0,946pH (B);
e2 = 1,69 - 0,54 + (0,0591/6)lg[H+]8 = 1,15 - 0,0788pH (B); D2G/F = -6,9 + 0,473pH (B)
e3 = 0,56 - 0,54 = 0,02(B) независимо от рН; D3G/F = - 0,04 B.
Наиболее выгодна та из реакций, у которой меньше DG в расчете на одно и тоже количество вещества (здесь - на 2 моль перманганата). Если в уравнениях конкурирующих реакций разные коэффициенты, то сначала надо их домножить так, чтобы они стали одинаковыми, а потом уже сравнивать DG. Реакции 1 и 2 равновероятны, если D1G=D2G. Решив это уравнение относительно рН, получаем рН=5,9. При меньших рН D1G<D2G, при больших - наоборот. Аналогично, приравняв D3G=D2G, найдем рН=14,5.
Вывод: если восстановитель в избытке, то в стандартных условиях вариант 1 термодинамически выгоднее в кислой среде (рН<5,9), вариант 2 - в нейтральной и щелочной (5,9<рН<14,5), а вариант 3 - лишь в очень сильно щелочной среде (рН>14,5).
Окислительно-восстановительные реакции (ОВР) (реакции окисления-восстановления) происходят с изменением степени окисления атомов, входящих в состав реагирующих веществ. При окислении веществ степень окисления элементов возрастает, при восстановлении - понижается.
Первоначально окислением называли только реакции веществ с кислородом, восстановлением - отнятие кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено на реакции, в которых кислород не участвует.
В неорганической химии окислительно-восстановительные реакции (ОВР) формально могут рассматриваться как перемещение электронов от атома одного реагента (восстановителя) к атому другого (окислителя), например:
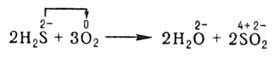
При этом окислитель восстанавливается, а восстановитель - окисляется. При протекании реакций в гальваническом элементе переход электронов осуществляется по проводнику, соединяющему электроды элемента, и изменение энергии Гиббса ДG в данной реакции может быть превращено в полезную работу. В отличие от реакций ионного обмена окислительно-восстановительные реакции (ОВР) в водных растворах протекают, как правило, не мгновенно.
При окислительно-восстановительных реакциях атомы в высшей степени окисления являются только окислителями, в низшей - только восстановителями; атомы в промежуточной степени окисления в зависимости от типа реакции и условий ее протекания могут быть окислителями или восстановителями. Многие окислительно-восстановительные реакции (ОВР) - каталитические По формальным признакам окислительно-восстановительные реакции (ОВР) разделяют на межмолекулярные (например, 2SO2 + O2 → SO3) и внутримолекулярные, например:
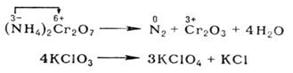
Последняя реакция представляет собой самоокисление-самовосстановление (см. Диспропорционирование).
окислительно-восстановительные реакции (ОВР) часто сопровождаются высоким энерговыделением, поэтому их используют для получения теплоты или электрической энергии. Наиболее энергичные окислительно-восстановительные реакции (ОВР) протекают при взаимодействии восстановителей с окислителями в отсутствие растворителя; в растворах такие реакции могут быть невозможны вследствие окислительно-восстановительного взаимодействия одного или обоих реагентов с растворителем. Так, в водном растворе нельзя непосредственно провести реакцию 2Na + F2 → 2NaF, поскольку натрий и фтор бурно взаимодействуют с водой. На окислительно-восстановительные свойства ионов сильно влияет комплексообразование, например: комплекс [Co2+(CN)6]4-, в отличие от гидратированного иона Со2+, является сильным восстановителем.
В случае окислительно-восстановительных реакций в органической химии использование обобщенной концепции окисления-восстановления и понятия о степени окисления часто малопродуктивно, особенно при незначительно полярности связей между атомами, участвующими в реакции. В органической химии окисление рассматривают обычно как процесс, при котором в результате перехода электронов от органического соединения к окислителю возрастает число (или кратность) кислородсодержащих связей (С — О, N — О, S — О и т.п.) либо уменьшается число водородсодержащих связей (С — Н, N —Н, S —Н и т.п.), например: RCHO → RCOOH; R2CHCHR2 → R2C=CR2. При восстановлении органических соединений в результате приобретения электронов происходят обратные процессы, например: R2CO → R2CH2; RSO2Cl → RSO2H.
Используют также подход, при котором атомам С в молекуле приписывают различные степени окисления в зависимости от числа связей, образованных с элементом более электроотрицательным, чем водород. В этом случае функциональные производные можно расположить в порядке возрастания их степени окисления. Так, насыщенные углеводороды относят к нулевой группе (приблизительная степень окисления — 4), R2C=CR2, ROH, RCl и RNH2 - к первой (- 2), RCCR, R2CO и R2CCl2 - ко второй (0), RCOOH, RCCCl, RCONH2 иRССl3 - к третьей (+2), RCN, CCl4 и СО2 - к четвертой (+4). Тогда окисление - процесс, при котором соединение переходит в более высокую категорию, а восстановление - обратный процесс.
Механизмы окислительно-восстановительных реакций весьма разнообразны; реакции могут протекать как по гетеролитическому, так и по гомолитическому механизму. Во многих случаях начальная стадия реакции - процесс одноэлектронного переноса. Окисление обычно протекает по положениям с наибольшей электронной плотностью, восстановление - по положениям, где электронная плотность минимальна. В органической химии используют широкий ряд восстановителей и окислителей, что позволяет выбрать реагент, обладающий селективностью (т.е. способностью действовать избирательно на определенные функциональные группы), а также получать продукты в требуемой степени окисления. Например, борогид Na восстанавливает кетоны или альдегиды до спиртов, не реагируя с амидами и сложными эфирами; LiAlH4 восстанавливает все эти соединения до спиртов. Среди окислителей высокой селективностью обладают, например, комплекс CrО3 с пиридином, с высоким выходом окисляющий спирты в кетоны, не затрагивая кратные связи С—С, а также SeO2, окисляющий кетоны и альдегиды до б-дикарбонильных соединений.
Селективность окислительно-восстановительных реакций может быть обеспечена и в каталитических процессах; например, в зависимости от катализатора и условий реакций ацетиленовые углеводороды можно селективно гидрировать до этиленовых или насыщенных углеводородов (см. Гидрирование). Электрохимическое восстановление СО2 до СО в водной среде в присутствии никелевого комплекса 1,4,8,11-тетраазациклотетрадекана позволяет проводить желаемый процесс при более низких потенциалах и одновременно подавлять электролиз воды с образованием Н2. Эта реакция имеет ключевое значение для превращения СО2 через СО в разнообразные органические вещества.
