Вода
Полное изменение энергии при образовании зародыша будет определяться соотношением
![]() .
.
Пусть ![]() , где N – число частиц в единице объема, тогда
, где N – число частиц в единице объема, тогда
![]()
Совершенно очевидно, что зависимость ![]() от N экстремальна.
от N экстремальна.
В точке максимума ![]() и
и 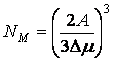 .
.
Если возник кристалл из ![]() частиц, то дальше кристаллизация пойдет спонтанно. Чем меньше
частиц, то дальше кристаллизация пойдет спонтанно. Чем меньше ![]() , тем должно быть больше число число частиц в возникшем кристалле, чтобы нивелировать роль поверхности по сравнению с объемом.
, тем должно быть больше число число частиц в возникшем кристалле, чтобы нивелировать роль поверхности по сравнению с объемом.
Это простое рассмотрение показывает, что чем больше ![]() , тем меньше возможная область переохлаждения, и чем меньше
, тем меньше возможная область переохлаждения, и чем меньше ![]() , тем область переохлаждения больше.
, тем область переохлаждения больше.
В связи со сказанным выше можно предположить, что разность химических потенциалов молекул Н2О сжатой воды и льдов II и III меньше, чем воды при Р = 1 атм. и льда I.
Объемная вода не допускает таких больших переохлаждений. Большие переохлаждения получают для маленьких капелек воды в эмульсиях или для воды в тонких капиллярах.
Молекула Н2О в жидкой фазе.
Большую информацию относительно усредненной во времени геометрии молекулы Н2О в жидкой фазе можно получить из данных для трех парных корреляционных функций жидкой воды:
![]() ,
, ![]() и
и ![]() .
.
Многочисленные исследования ![]() Нартена и его сотрудников (1962, 1971, 1982) показали, что первый максимум кривой радиального распределения находится на расстоянии 2,85 Å при Т = 25°С, которое на 6% больше, чем расстояние 2,76 Å (лед I). Площадь под кривой согласуется с предположением 4, 4 соседа около каждой молекулы Н2О. Число следующих соседей оказывается большим, чем во льду I h.
Нартена и его сотрудников (1962, 1971, 1982) показали, что первый максимум кривой радиального распределения находится на расстоянии 2,85 Å при Т = 25°С, которое на 6% больше, чем расстояние 2,76 Å (лед I). Площадь под кривой согласуется с предположением 4, 4 соседа около каждой молекулы Н2О. Число следующих соседей оказывается большим, чем во льду I h.
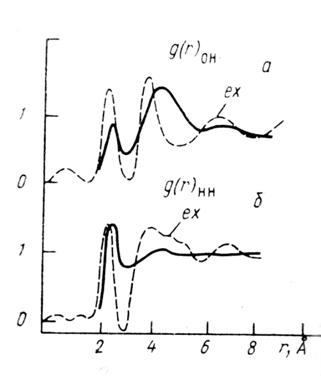
Во многих льдах под давление уплотнение структуры сопровождается не просто увеличением О – О расстояний между ближайшими соседями, а переходом от единого расстояния между О – О во льду I к набору расстояний во льдах под давлением. В жидкой воде картина очень похожа. Согласно данным Вэлла и Хорнинга (1965), полученным ими на основании КР спектров из сравнения зависимости ![]() (валентных частот О – Н связи) от О – О расстояния, распределение длин О – О в жидкой воде имеет вид, представленный на рис.2. Распределение расстояний О – О в воде оказывается очень широким. Максимум имеет место при 2,86 Å, однако распределение длин связи простирается от 2,75 Å до величин, равных •3,05 Å.
(валентных частот О – Н связи) от О – О расстояния, распределение длин О – О в жидкой воде имеет вид, представленный на рис.2. Распределение расстояний О – О в воде оказывается очень широким. Максимум имеет место при 2,86 Å, однако распределение длин связи простирается от 2,75 Å до величин, равных •3,05 Å.


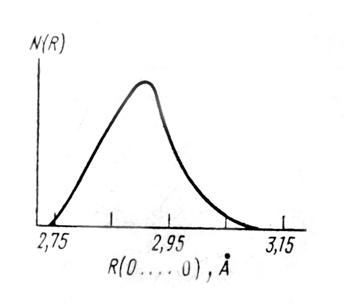
 Формы корреляционных функций
Формы корреляционных функций ![]() и
и ![]() , полученные с помощью численных расчетов (Доре, 1984) показаны на рис.3 сплошными линиями, а экспериментальные результаты данных нейронной дифракции показаны пунктиром. Как видно из представленных рисунков, наблюдается три максимума для
, полученные с помощью численных расчетов (Доре, 1984) показаны на рис.3 сплошными линиями, а экспериментальные результаты данных нейронной дифракции показаны пунктиром. Как видно из представленных рисунков, наблюдается три максимума для ![]() . Первый максимум находится на расстоянии •1,86 Å, второй •3,2 Å, а третий •5,5 Å. Первый максимум соответствует расстоянию между кислородом центральной молекулы и протонами других молекул, связанных с ней водородной связью. Второй максимум соответствует расстоянию между кислородом центральной молекулы и протонами ближайших ее соседей, которые не участвуют с ней в водородной связи. Третий максимум соответствует расстоянию между кислородом центральной молекулы и протонами молекул Н2О из второй координационной сферы.
. Первый максимум находится на расстоянии •1,86 Å, второй •3,2 Å, а третий •5,5 Å. Первый максимум соответствует расстоянию между кислородом центральной молекулы и протонами других молекул, связанных с ней водородной связью. Второй максимум соответствует расстоянию между кислородом центральной молекулы и протонами ближайших ее соседей, которые не участвуют с ней в водородной связи. Третий максимум соответствует расстоянию между кислородом центральной молекулы и протонами молекул Н2О из второй координационной сферы.
Как видно из рис.3, ![]() имеет три максимума при r1•2,2 Å, r2•3,6 Å и r3•6,5 Å. Первый максимум соответствует расстоянию между протонами центральной молекулы и протонами молекул первой координационной сферы, участвующих в водородной связи с центральной. Второй максимум, по-видимому соответствует расстоянию между протонами центральной молекулы и протонами первой координационной сферы, не участвующих в водородной связи с центральной, а третий – соответствует распределению протонов второй координатной сферы относительно протонов центральной молекулы.
имеет три максимума при r1•2,2 Å, r2•3,6 Å и r3•6,5 Å. Первый максимум соответствует расстоянию между протонами центральной молекулы и протонами молекул первой координационной сферы, участвующих в водородной связи с центральной. Второй максимум, по-видимому соответствует расстоянию между протонами центральной молекулы и протонами первой координационной сферы, не участвующих в водородной связи с центральной, а третий – соответствует распределению протонов второй координатной сферы относительно протонов центральной молекулы.
Как видно из представленных данных, расчетные и экспериментальные функции для ![]() хорошо согласуются между собой, в то время как расчетная кривая
хорошо согласуются между собой, в то время как расчетная кривая ![]() не выявляет четкой структуры экспериментальной зависимости от расстояния между Н – Н.
не выявляет четкой структуры экспериментальной зависимости от расстояния между Н – Н.
Замещение части Н на D приводит к деформации кривой распределения ![]() и практически не сказывается на форме кривой распределения
и практически не сказывается на форме кривой распределения ![]() (Доре, 1984).
(Доре, 1984).
Эти эксперименты указывают на неэквивалентность Н и D в жидкой воде.
По данным Паулюса (1981), расстояние OD при 21°С в жидкой воде равно rOD = 0,98 ± 0,00 Å; rDD = 1,55 ± 0,02 Å; угол DOD = 104 ± 2°.
Свободная молекула в пару имеет rOD = 0,969 Å при той же температуре, а во льду I/rOD = 1,01 Å.
Эти результаты свидетельствуют в пользу того, что геометрия молекулы Н2О в жидкой воде изменена меньше, чем во льду I h.
Из данных по рассеянию электронов в жидкой воде (Кальман, 1977) следует, что геометрия молекулы в жидкой воде близка к свободной молекуле Н2О в газе. Длина водородной связи в жидкой воде равна 1,85 Å. В ней принимают участие оба протона. Характерные расстояния между кислородами оказались равными 2,85 Å, 4,5 Å и 7 Å. Была подтверждена тетраэдрическая координация молекул.
