Вода
Теплоемкость льда имеет очень низкое значение. Она по абсолютной величине близка к теплоемкости одноатомных кристаллов, таких как Na (табл.2). Теплоемкость твердого Н2 выше теплоемкости льда. Близкой теплоемкостью к теплоемкости льда обладает жидкий аммиак.
В процессе плавления теплоемкость металлов практически не изменяется, для веществ из многоатомных молекул в процессе плавления, как правило, она уменьшается. Это, по-видимому, связано с тем, что молекулы могут свободно вращаться в жидкости и не могут свободно вращаться в твердом теле. Для соединения, таких как Н2О и NH3, теплоемкость в жидком состоянии много больше, чем теплоемкость в твердом состоянии.

 Мы полагаем, что рост теплоемкости Н2О при плавлении льда обусловлен тем, что для молекулы Н2О в воде, в деформированной температурой поле соседей, характерны как внутримолекулярные, так и межмолекулярные переходы протонов. Это означает, что вода может быть рассмотрена как 3N-атомная связанная система и ее теплоемкость согласно закону Дюлонга и Пти должна иметь значение 18 ккал/моль.
Мы полагаем, что рост теплоемкости Н2О при плавлении льда обусловлен тем, что для молекулы Н2О в воде, в деформированной температурой поле соседей, характерны как внутримолекулярные, так и межмолекулярные переходы протонов. Это означает, что вода может быть рассмотрена как 3N-атомная связанная система и ее теплоемкость согласно закону Дюлонга и Пти должна иметь значение 18 ккал/моль.
Увеличение теплоемкости воды при переохлаждении, по-видимому, связано с гетерофазностью структуры (Ангел, 1973).
Уменьшение теплоемкости при образовании кристалла льда обусловлено, по нашему мнению, переходом к линейным водородным связям, к анизотропии колебаний протонов, что приводит к атрофии двух степеней свободы на каждый протон.
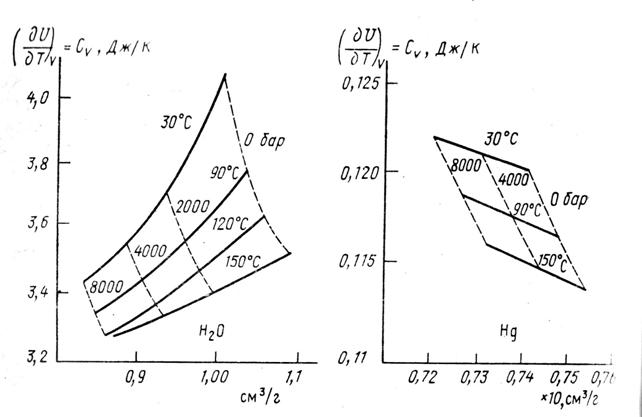
Зависимость СV от молекулярного объема, приходящегося на грамм вещества, для ряда температур и давлений представлена на рис.7 (Линд, 1971): слева для Н2О, справа для ртути. Как видно, СV воды уменьшается с ростом Т и Р. Теплоемкость ртути по сравнению с водой очень мало изменяется при изменении Т и Р и имеет обратную зависимость от давления (теплоемкость ртути растет с ростом давления).
Как видно из рис.7 с ростом температуры воды зависимость СV от молекулярного объема становится все более похожей на зависимости для ртути. Можно предполагать, что при температуре, близкой к 270°С, зависимость СV от молекулярного объема для Н2О потеряет свою аномальность.
Зависимость (дU/дV)Т от V
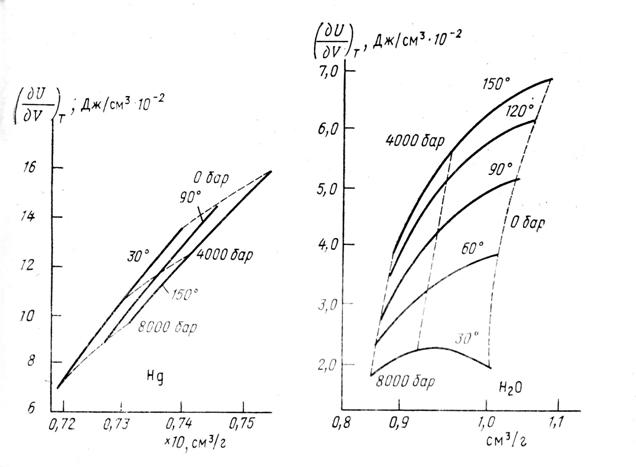
Изменение ![]() от молекулярного объема для ртути и воды представлено на рис.8. Как видно,
от молекулярного объема для ртути и воды представлено на рис.8. Как видно, ![]() от V обычной жидкости ртути монотонно растет с ростом молекулярного объема. Для фиксированного значения V
от V обычной жидкости ртути монотонно растет с ростом молекулярного объема. Для фиксированного значения V ![]() ртути уменьшается с ростом температуры.
ртути уменьшается с ростом температуры.
Величина ![]() в воде растет с ростом температуры при V = const.
в воде растет с ростом температуры при V = const.
В воде в отличие от ртути зависимость ![]() от V для разных температур оказывается существенно неодинаковой. Так, при Т = 30°С
от V для разных температур оказывается существенно неодинаковой. Так, при Т = 30°С ![]() имеет максимум в районе V = 0,93-0,94 см3/г. Это означает, что UT от V испытывает перегиб при этом давлении или, другими словами, UT сложная функция от V или r, где r – расстояние между молекулами.
имеет максимум в районе V = 0,93-0,94 см3/г. Это означает, что UT от V испытывает перегиб при этом давлении или, другими словами, UT сложная функция от V или r, где r – расстояние между молекулами.
Сопоставление зависимостей СV от V и ![]() от V показывает следующее. В том интервале V, где
от V показывает следующее. В том интервале V, где ![]() растет с ростом V, теплоемкость воды CV наиболее медленно изменяется с ростом V. Когда же
растет с ростом V, теплоемкость воды CV наиболее медленно изменяется с ростом V. Когда же ![]() уменьшается с ростом V, теплоемкость неограниченно растет. Таким образом, из зависимости
уменьшается с ростом V, теплоемкость неограниченно растет. Таким образом, из зависимости ![]() уже при 30°С очевидно, что в воде сосуществуют две возможности взаимодействия молекул, одна из которых характеризуется максимальным из возможных молекулярных объемов в жидком состоянии при температурах ниже 30°С, а другая – сжатым состоянием структуры •2000 бар и выше для температур ниже 30°С. Изменение энергии водородных связей в воде в рыхлом состоянии при увеличении молекулярного объема на 0,01 см3/г меньше, чем изменение энергии водородных связей для «сжатой» структуры с уменьшением молекулярного объема на 0,01 см3/г.
уже при 30°С очевидно, что в воде сосуществуют две возможности взаимодействия молекул, одна из которых характеризуется максимальным из возможных молекулярных объемов в жидком состоянии при температурах ниже 30°С, а другая – сжатым состоянием структуры •2000 бар и выше для температур ниже 30°С. Изменение энергии водородных связей в воде в рыхлом состоянии при увеличении молекулярного объема на 0,01 см3/г меньше, чем изменение энергии водородных связей для «сжатой» структуры с уменьшением молекулярного объема на 0,01 см3/г.

Эта зависимость, как это было рассмотрено раньше, и определяет относительно маленький интервал переохлаждения при Т = 1 атм и максимальный интервал переохлаждения при Р•2000 атм, как мы предполагаем.
Зависимость (дS/дV) от V
Изменение энтропии при изменении Т и V определяется двумя членами:

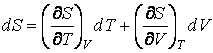 .
.
 Если V = const, то изменение энтропии определяется уже рассмотренной зависимостью CV:
Если V = const, то изменение энтропии определяется уже рассмотренной зависимостью CV:
 .
.
Если же Т постоянно, то
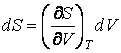 .
.
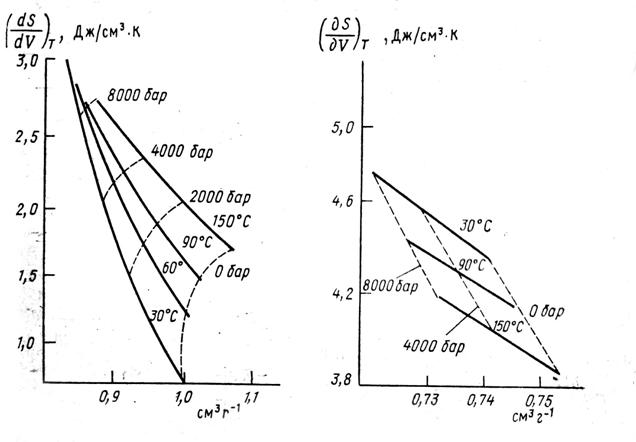
Зависимость ![]() для ртути и воды предоставлена на рис.9. Как видно из рис.9, зависимость
для ртути и воды предоставлена на рис.9. Как видно из рис.9, зависимость ![]() от V для воды нелинейна, а для ртути линейна. Для фиксированного значения V
от V для воды нелинейна, а для ртути линейна. Для фиксированного значения V ![]() растет с ростом T для воды и уменьшается для ртути.
растет с ростом T для воды и уменьшается для ртути.
Таким образом, особенности зависимости производных термодинамических функций от V для воды наиболее ярко выражены при малых температурах (![]() °С) и малых давлениях (
°С) и малых давлениях (![]() атм).
атм).
Зависимость объема и его производных от температуры
Изменение объема с температурой. На рис.10 представлены зависимости молярно объема воды и льда Н2О и D2O от Т (Айзенберг, Козман, 1969). Как видно, с ростом температуры объем того и другого соединения изменяется по-разному. Максимальная разница в объемах D2O и Н2О наблюдается при Т = 0°С. Объем D2O приблизительно на 0,1 см3/моль больше, чем объем Н2О при Т = 0°С. При Т = 100°С эта разница составляет ~0,037 см3/моль. Зависимости изменения объема от температуры для Н2О и D2O становятся практически одинаковыми, начиная с температуры ~80°С. Уменьшение объема воды при плавлении льда I, по нашему мнению, связано с тем, что при плавлении изменяется динамика водородных связей и активируются в измененном температурой поле взаимодействующих молекул внутримолекулярные переходы протонов. Их доля по нашим подсчетам из данных по экстраполированной плотности льда I к 4°С и экстраполированной плотности льда II к 4°С оказывается одинаковой при 4°С.
