Вода
Сравнивая спектры валентных колебаний жидкой воды и разбавленных растворов воды в CCl4 и CHCl3, Стивенсон (1965) пришел к выводу, что в жидкой фазе отсутствуют газообразные молекулы воды в количествах, достаточных для спектрального анализа. Этот факт служит экспериментальным доказательством непрерывности структуры водородных связей в жидкой воде.
Уорли и Клотц (1966) определили на основании температурной зависимости спектра HDO в области 1,4 мк энтальпию перехода для групп ОН…О от связанного состояния к свободному и получили величину ![]() = 2,37 ккал/моль. Результаты многих спектральных исследований, выполненных разными авторами, показывают, что величина энтальпии перехода от связанного состояния ОН…О к несвязанному или сильно деформированному составляют приблизительно 2-3 ккал/моль.
= 2,37 ккал/моль. Результаты многих спектральных исследований, выполненных разными авторами, показывают, что величина энтальпии перехода от связанного состояния ОН…О к несвязанному или сильно деформированному составляют приблизительно 2-3 ккал/моль.
Полосы поглощения 50, 170 и 290 см-1, обнаруженные Кроссом (1937), Велсом и Хорнингом (1965) и Московицем и Микаэляном (1978), относятся к О – О колебаниям водородосодержащих молекул. При изотопном замещении Н на D эти частоты не изменяются.
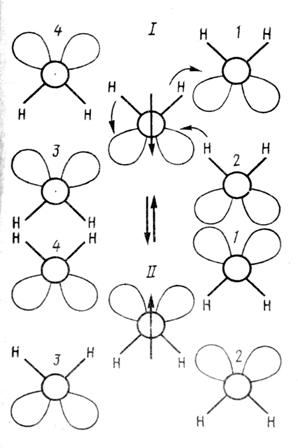


 Спектр КР O – D колебаний при температурах •-25°С свидетельствует в пользу того, что имеют место два типа связей O – D, которые формируют спектр (Бансиль и др., 1981). Было обнаружено, что ширина связи аномально сужается при понижении температуры в области переохлаждения. Эти факты свидетельствуют в пользу сужения распределений длин и углов в сверхохлажденном состоянии. Мы полагаем, что это является следствием уменьшения вклада дисперсионного взаимодействия осциллирующих протонов в общую энергию взаимодействия при малых Т. На рис.4 вверху показано начальное положение системы пяти молекул Н2О в линейном приближении. Как видно из рисунка, молекулы 1 и 2 взаимодействуют c центральной молекулой посредством практически линейных водородных связей. Водородные связи молекул 3 и 4 с центральной молекулой изогнуты так, как это имеет место во льду II (в данном случае нарисовано предельное (утрированное) изгибание водородных связей в жидкой воде), возможно, одновременно, а возможно, независимо, как это показано для системы (Н2О с D2O). Один протон центральной молекулы переходит от нее к молекуле 1, а второй протон изменяет свое положение внутри центральной молекулы, и система переходит в состояние II, как это показано на рис. внизу. Если внутримолекулярные и межмолекулярные частоты переходов протонов равны (близки), то дипольный момент молекулы будет переворачиваться на 180°, а если они различны, то с частотой внутримолекулярных и межмолекулярных переходов дипольной момент молекулы будет изменять свое направление •90°С.
Спектр КР O – D колебаний при температурах •-25°С свидетельствует в пользу того, что имеют место два типа связей O – D, которые формируют спектр (Бансиль и др., 1981). Было обнаружено, что ширина связи аномально сужается при понижении температуры в области переохлаждения. Эти факты свидетельствуют в пользу сужения распределений длин и углов в сверхохлажденном состоянии. Мы полагаем, что это является следствием уменьшения вклада дисперсионного взаимодействия осциллирующих протонов в общую энергию взаимодействия при малых Т. На рис.4 вверху показано начальное положение системы пяти молекул Н2О в линейном приближении. Как видно из рисунка, молекулы 1 и 2 взаимодействуют c центральной молекулой посредством практически линейных водородных связей. Водородные связи молекул 3 и 4 с центральной молекулой изогнуты так, как это имеет место во льду II (в данном случае нарисовано предельное (утрированное) изгибание водородных связей в жидкой воде), возможно, одновременно, а возможно, независимо, как это показано для системы (Н2О с D2O). Один протон центральной молекулы переходит от нее к молекуле 1, а второй протон изменяет свое положение внутри центральной молекулы, и система переходит в состояние II, как это показано на рис. внизу. Если внутримолекулярные и межмолекулярные частоты переходов протонов равны (близки), то дипольный момент молекулы будет переворачиваться на 180°, а если они различны, то с частотой внутримолекулярных и межмолекулярных переходов дипольной момент молекулы будет изменять свое направление •90°С.
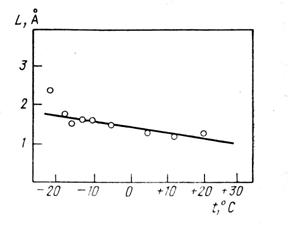
На основании данных по сравнению частот либрационных колебаний молекул Н2О во льду I и в воде можно предположить, что частоты внутримолекулярных и межмолекулярных переходов протонов одинаковы в воде и равны •1000 см-1 Из данных по рассеянию нейтронов Тейхейра и др. (1984) следует, что протон в жидкой воде в диапазоне температур от +20 до -20°С диффундирует скачками. Длина скачка практически не зависит от температуры и равна 1,6 Å (рис.5). Это расстояние равно расстоянию протонов внутри молекулы Н2О, что свидетельствует в пользу развиваемой нами концепции.
III ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА
Основные аномалии воды проявляются в особенностях зависимости от температуры и зависимости от давления производных термодинамических функций, а именно в немонотонности их зависимости от Т и Р и часто обратной зависимости от этих параметров по сравнению с обычными жидкостями при температурах, близких к температуре плавления, и давления Р = 1 атм.

 В дальнейшем мы будем прибегать к сравнению изменения ряда физических свойств при плавлении льда I и изменением аналогичных свойств при плавлении четыреххлористого углерода или ртути (обычных жидкостей). Четыреххлористый углерод выбран нами из-за того, что молекула CCl4 имеет тетраэдрическое расположение атомов Cl и температура плавления твердого CCl4 (250,14 К) и температура кипения (348,41 К) близки к соответствующим температурам для воды. Жидкая ртуть представляет собой типичную простую жидкость. При плавлении CCl4 энтропия изменяется на 2,31 кал/моль·град, а при плавлении Н2О
В дальнейшем мы будем прибегать к сравнению изменения ряда физических свойств при плавлении льда I и изменением аналогичных свойств при плавлении четыреххлористого углерода или ртути (обычных жидкостей). Четыреххлористый углерод выбран нами из-за того, что молекула CCl4 имеет тетраэдрическое расположение атомов Cl и температура плавления твердого CCl4 (250,14 К) и температура кипения (348,41 К) близки к соответствующим температурам для воды. Жидкая ртуть представляет собой типичную простую жидкость. При плавлении CCl4 энтропия изменяется на 2,31 кал/моль·град, а при плавлении Н2О ![]() = 5,25 кал/моль·град. Соответственно
= 5,25 кал/моль·град. Соответственно ![]() = 1,430 ккал/моль, а
= 1,430 ккал/моль, а ![]() = 0,578 ккал/моль. Изменение энтальпии и энтропии при плавлении льда значительно больше (~2 раза), чем аналогичное изменение при плавлении CCl4. Изменения же энтропии при испарении воды и CCl4 оказываются значительно ближе друг к другу. Величина
= 0,578 ккал/моль. Изменение энтальпии и энтропии при плавлении льда значительно больше (~2 раза), чем аналогичное изменение при плавлении CCl4. Изменения же энтропии при испарении воды и CCl4 оказываются значительно ближе друг к другу. Величина ![]() кал/моль·град и
кал/моль·град и ![]() кал/моль·град. Если на эти числа посмотреть, как на характеристики перехода от порядка к беспорядку, то вода в жидком состоянии значительно более беспорядочна, чем CCl4.
кал/моль·град. Если на эти числа посмотреть, как на характеристики перехода от порядка к беспорядку, то вода в жидком состоянии значительно более беспорядочна, чем CCl4.
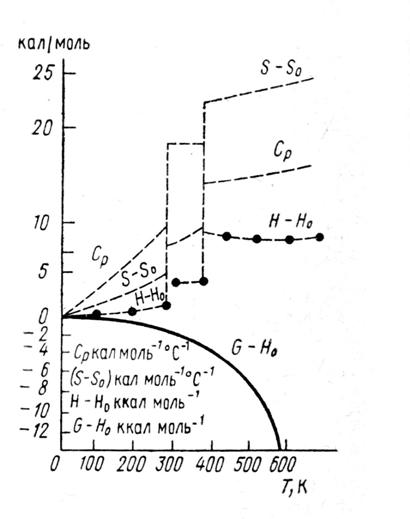
На рис.6 представлена зависимость от температуры ряда термодинамических величин для Н2О (Айзенберг, Козман, 1969). Как видно, энтропия Н2О возрастает при плавлении, растет с ростом температуры в жидком состоянии и испытывает наибольшее изменение при переходе жидкость – газ. Аналогично ведет себя и энтальпия. Теплоемкость при постоянном давлении оказывается максимальной в жидком состоянии. Жидкое состояние как бы представляет экстремум СР. Свойства теплоемкости других производных от термодинамических функций мы рассмотрим более подробно в сравнении с аналогичным свойствами ртути.
Теплоемкость
|
Таблица 2 | ||||||||||
| Теплоемкости ряда веществ в трех агрегатных состояниях | ||||||||||
| Вещество |
Na |
Hg |
Zn |
H2 |
Cl2 |
Br2 |
HCl |
CH4 |
NH3 |
H2O |
|
CP (жидк.), Кал/моль | 736 | 6,8 | 7,2 | 11 | 14 | 14 | 12 | 11 | 12 | 18 |
|
CP (тверд.), Кал/моль | 8,0 | 6,7 | 7,9 | 13 | 16 | 17 | 15 | 14 | 9 | 9 |
|
CP (газообр.), Кал/моль | 5,0 | - | - | 6,88 | 8,58 | 8,88 | 6,68 | - | 9,94 | 8,65 |
