Вода
Мы предполагаем, что в воде при 4°С осуществляется в каждой молекуле Н2О и внутримолекулярные и межмолекулярные переходы протонов, как это показано на рис.10.

|
|
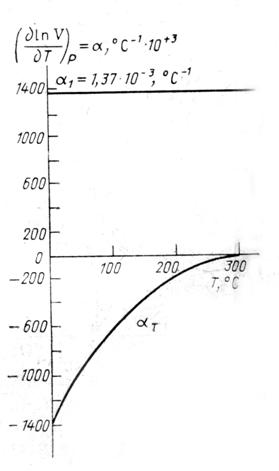
С целью исследования температурной зависимости «аномальной» составляющей объема воды выделим из общего объема долю объема, определяемую ростом энергии локального взаимодействия молекул Н2О с уменьшением температуры ниже 30°С (Зацепина, 1971). Для этого примем, что в районе ![]() К вода ведет себя как обычная жидкость с постоянным коэффициентом объемного расширения
К вода ведет себя как обычная жидкость с постоянным коэффициентом объемного расширения
![]() град-1,
град-1,
который мы оценили экстраполяцией экспериментального значения ![]() в область высоких температур. Помимо постоянной составляющей
в область высоких температур. Помимо постоянной составляющей ![]() в воде имеет место другая составляющая,
в воде имеет место другая составляющая, ![]() . На рис.11 представлены обе составляющие
. На рис.11 представлены обе составляющие ![]() . Как видно, для воды помимо характерно для нормальных жидкостей постоянного, не зависящего от температуры
. Как видно, для воды помимо характерно для нормальных жидкостей постоянного, не зависящего от температуры ![]() град-1, имеет место отрицательная составляющая коэффициента объемного расширения. В область температур, где
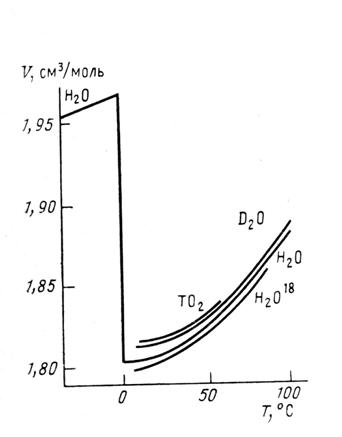
град-1, имеет место отрицательная составляющая коэффициента объемного расширения. В область температур, где ![]() объем практически линейно зависит от температуры и может быть записан в виде V1 = 1,05·10-3 Т + 0,63. Будем считать, что эта зависимость изменения объема с температурой определяет нормальную составляющую уменьшения объема воды с уменьшением температуры для всех температур жидкого состояния. Разность между экспериментальными значениями объема и значениями V1(T) представляют собой аномальную составляющую температурной зависимости молекулярного объема воды: V2(T) = V(T) – V1(T); V2(T) = 3·10-6(T - 433)2; для T<433 К V(T) – экспериментальная зависимость, V2(T) – уменьшающийся с ростом температуры вклад в молекулярный объем, который определяется аномальную зависимость V(T). Для V2 коэффициент объемного расширения всюду отрицателен и уменьшается (по модулю) с ростом температуры. Таким образом, экспериментальная кривая изменения объема с температурой жидкой воды качественно может быть представлена суммой двух компонент
объем практически линейно зависит от температуры и может быть записан в виде V1 = 1,05·10-3 Т + 0,63. Будем считать, что эта зависимость изменения объема с температурой определяет нормальную составляющую уменьшения объема воды с уменьшением температуры для всех температур жидкого состояния. Разность между экспериментальными значениями объема и значениями V1(T) представляют собой аномальную составляющую температурной зависимости молекулярного объема воды: V2(T) = V(T) – V1(T); V2(T) = 3·10-6(T - 433)2; для T<433 К V(T) – экспериментальная зависимость, V2(T) – уменьшающийся с ростом температуры вклад в молекулярный объем, который определяется аномальную зависимость V(T). Для V2 коэффициент объемного расширения всюду отрицателен и уменьшается (по модулю) с ростом температуры. Таким образом, экспериментальная кривая изменения объема с температурой жидкой воды качественно может быть представлена суммой двух компонент
V(T) = 0,63+1,05·103T+3·106(T - 433)2
в районе температур 263 – 433 К.
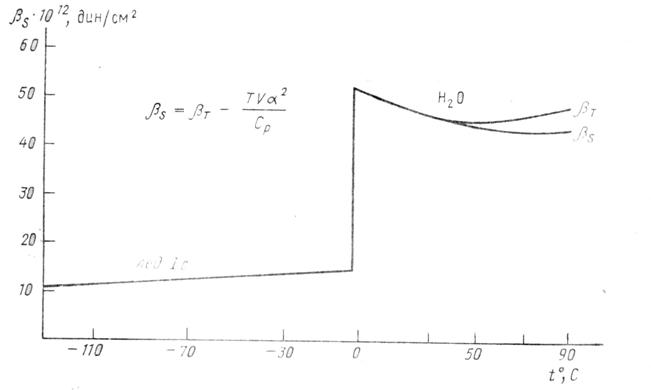
Изотермическая и адиабатическая сжимаемость. Изотермическая сжимаемость воды при температуре Т = 0°С в четыре раза больше, чем изотермическая сжимаемость льда. Зависимость изотермической сжимаемости льда и воды от температуры представлены на рис. 12 на основании данных работы Келла (1967). Как видно, максимальное изменение в представленном интервале температур сжимаемость испытывает при плавлении.
С ростом температуры сжимаемость уменьшается, и при ![]() 50°С сжимаемость изменяет знак производной и приобретает температурную зависимость, аналогичную температурной зависимости сжимаемости обычных жидкостей.
50°С сжимаемость изменяет знак производной и приобретает температурную зависимость, аналогичную температурной зависимости сжимаемости обычных жидкостей.

Сжимаемость воды и льда по сравнению с сжимаемостью других веществ мала (табл.3). Малую сжимаемость воды по сравнению с другими жидкостями и
|
Таблица 3 | ||||
| Сжимаемость ряда веществ в интервале температур от (5-30ºС) | ||||
| Т, ºС |
| Метанол | Бензин | |
| Н2О | D2O | |||
| 5 | 51,6 | 84,2 | ||
| 10 | 48,7 | 114,9 | 88,5 | |
| 15 | 49,25 | 118,8 | 92,2 | |
| 25 | 46,6 | 48,18 | 122,7 | 95,6 |
| 20 | 47,40 | 126,9 | 99,7 | |
| 30 | 45,8 | 46,76 | 131,0 | 103,1 |
большую сжимаемость воды при Т = 0°С по сравнению с сжимаемостью льда и сжимаемостью воды при Т = 50°С объясняют особенности водородных связей во льду и в воде.
Термодинамические свойства воды при переохлаждении.
Обнаружены в ряде работ Минэсяна и др. (1981), Ангела и др. (1973, 1976) аномалии коэффициента расширения, теплоемкости и сжимаемости в переохлажденной воде.
В работе Минэсяна и др. был измерен экспериментально коэффициент объемного расширения воды ![]() в интервале температур 28 - 120°С.
в интервале температур 28 - 120°С.
